В данной главе представлены традиционные и современные методы культивирования микроорганизмов, отличающиеся повышенной точностью, чувствительностью и селективностью. Представить полный перечень таких методов весьма затруднительно, так как их совершенствование идет непрерывно и очень высокими темпами. Можно с уверенностью сказать, что возможности той или иной области науки продиктованы прежде всего используемыми в ней методами, и материал, представленный здесь, крайне важен для пищевой микробиологии.
Принципиальной основой пищевой микробиологии являются методы анализа пищевых продуктов на наличие и количество микроорганизмов или их метаболитов.
Но ни один из используемых методов не позволяет установить точное число микроорганизмов в продовольственном продукте, так как каждый метод имеет некоторые ограничения в использовании.
Гомогенизация – процесс уменьшения неоднородности смесей, состоящих из твердых веществ, в текучей среде (жидкостях или газах), путем измельчения и равномерного перераспределения их по объему. Например, при помощи гомогенизации жир в молоке может быть разбит так тщательно, что частицы повторно не рекомбинируются и сливки не образуются.
Техника гомогенизации состоит из следующих способов:
- перемешивания дисперсных систем с жидкой дисперсионной средой быстро вращающимся ротором диспергатора или венчиком;
- прокачивания дисперсных систем типа жидкость/жидкость (например, молока) под давлением до 5–400 атм через отверстие головки гомогенизатора, возникающие при этом гидродинамические силы дробят фрагменты дисперсной фазы на более мелкие;
- перемешивания порошков в многоосных, Y-образных или Z-образных смесителях;
- ультразвуковой кавитационной гомогенизации дисперсных систем газ/жидкость и жидкость/газ.
Любая проба, доставленная в лабораторию, нуждается в дополнительной гомогениизации перед ее сокращением – в противном случае ее представительность не может быть гарантирована. Если неоднородность пробы (наличие в ней различных фаз) видна на глаз, то качество гомогенизации может определять качество результатов анализа в целом. Стандартные рабочие методики, описывающие стадию подготовки пробы, должны предусматривать разнообразные способы гомогенизации. При оценке общей погрешности результатов необходимо количественно оценить погрешность, связанную со стадией сокращения пробы. Последняя погрешность определяет число сокращенных проб, которые следует проанализировать, чтобы достичь требуемой точности результатов анализа.
Для выполнения процедур пробоподготовки используется необходимое основное оборудование.
Вплоть до конца 1970-х гг. образцы перед посевом почти исключительно измельчали механически – посредством растирания, разрезания на мелкие кусочки и т.п. A.N. Sharpe и А.К. Jackson в 1971 г. разработали устройство для гомогенизации пищевых продуктов. Гомогенизатор – механическое устройство, которое за счет физического воздействия измельчает образец. Эффект удара состоит в разрезании образцов пищевых продуктов; выделяющиеся при этом микроорганизмы суспендируются в растворителе (рис. 4.1).

Рис. 4.1.
Гомогенизатор Stomacher лабораторный ECO Blender II (PBI)
Гомогенизатор Stomacher можно сопоставить с высокоскоростным блендером для анализа пищевых продуктов. Результаты определения числа микроорганизмов в образцах, гомогенезированных на Stomacher, не отличаются от таковых в образцах, подготовленных блендером. Устройство выгодно отличается от блендера, так как:
- не требуется очищать части гомогенизатора;
- сохраняется температура образца;
- подготовленные образцы можно сохранить в замороженном виде для дальнейшего исследования;
- создается меньше шума, чем в блендере.
Показано уменьшение летального действия Stomacher на Staphylococcus aureus, Enterococcus faecalis и Escherichia coli. по сравнению с блендером.
Stomacher предпочтителен для продуктов питания.
При гомогенизации мяса с использованием Stomacher не происходит обширного разрушения тканей мяса и, как следствие, в составе гомогената в меньшем количестве присутствуют восстанавливающие компоненты, взаимодействующие с резазурином. Тогда как при перемешивании уровень восстанавливающих компонентов, взаимодействующих с резазурином, значительно выше.
Устройство под названием Pulsifier сходно с гомогенизатором Stomacher. В нем создается уровень турбулентности, позволяющий более полно извлекать из продукта микроорганизмы.
Гомогенизатор Pulsifier имеет электромотор, приводящий в движение ударное кольцо из нержавеющей стали, которое дополнительно вибрирует для интенсивного перемешивания/взбалтывания пробы. Это обеспечивает максимальный переход микроорганизмов из образца в суспензию, не деформируя продукт. Он позволяет подготовить пробу с максимальной экстракцией бактериальных клеток.
Проба помещается в специальный пакет, который плотно запечатывается во избежание попадания в окружающее пространство аэрозоля, содержащего бактерии. За процессом гомогенизации можно наблюдать через прозрачное окно. Контрольная LCD-панель позволяет устанавливать программу или время, она также имеет кнопку «Пауза», чтобы можно было остановить процесс, а затем продолжить его, не начиная заново.
Гомогенизатор Pulsifier имеет следующие преимущества:
- суспензия является более чистой и менее густой, чем при обработке с помощью других приборов;
- образец после обработки содержит меньше пищевых частиц;
- образцы более пригодны для молекулярных методов исследования;
- затрачивается меньше времени на подготовку образца.
Для подсчета числа микроорганизмов используют следующие методы исследования: СПК – стандартный подсчет колоний; КОЕ – определение колониеобразующих единиц; АПК – аэробный подсчет колоний; НВЧ – наиболее вероятное число жизнеспособных клеток; подсчет числа жизнеспособных клеток, обладающих редуктазной системой; прямой подсчет микроорганизмов.
4.2. СТАНДАРТНЫЙ ПОДСЧЕТ КОЛОНИЙ
Сущность метода заключается в подсчете жизнеспособных микроорганизмов посредством посева на питательные среды, на которых микробные клетки в процессе деления образуют колонии, видимые невооруженным глазом.
Метод СПК предусматривает измельчение и гомогенизацию образца пищевых продуктов, его растворение в растворителе. Затем некоторое количество гомогената, разбавленного в растворителе, высевают на агаровую среду (поверхностным или глубинным методом) и инкубируют при соответствующей температуре в течение определенного времени. Потом подсчитывают все видимые колонии с использованием счетчика колоний. Метод СПК наиболее широко используется для определения числа жизнеспособных клеток или колониеобразующих единиц (КОЕ) в пищевых продуктах. Количество обнаруживаемых микроорганизмов рассматривается как функция следующих факторов: систематической группы микробиоты продукта; избранного метода исследования; истории пищевого продукта до исследования; состава плотных питательных сред; температуры и времени инкубирования; рН, влажности и окислительно-восстановительного потенциала плотных питательных сред; относительного количества микроорганизмов в образце; наличия других конкурентных или антагонистических организмов.
В основе СПК лежит чаще всего глубинный посев, однако нельзя исключать использования поверхностного посева, потому что результаты обоих методов вполне сравнимы. Растворенный методом серийных разведений образец в количестве 0,1, 0,5 или 1,0 мл наносится на поверхность питательной среды. Затем с помощью изогнутого стеклянного или пластикового шпателя образец круговыми движениями равномерно распределяется по всей поверхности. При использовании этого метода посева в пищевых продуктах сохраняются чувствительные к высокой температуре психрофилы, потому что микроорганизмы не контактируют с горячим расплавленным агаром. Для строгих аэробов предпочтителен поверхностный посев, но микроаэрофильные организмы при таком посеве имеют тенденцию к медленному росту. При посеве на поверхность агаровой пластинки необходимо равномерное растирание инокулята, чего трудно добиться на влажной поверхности. Избежать этого неудобства можно кратковременным подсушиванием агаризированной среды в боксе.
Спиральный плоттер. Метод спирального плоттера (спирального посева) – это метод учета жизнеспособных микроорганизмов. Спиральный плоттер – механическое устройство, которое распределяет жидкий гомогенат по поверхности вращающейся чашки Петри, содержащей соответствующий жидкий или плотный агар (рис. 4.2).

Рис. 4.2.
Спиральный плоттер Eddy Jet 2
От центра пластины к ее краям, распределяя образец по Архимедовой спирали, перемещается распределяющее устройство (рука), которое специальным прикрепленным шприцом отливает непрерывно уменьшающийся объем образца так, что концентрация в центре и у края достигает соотношения 10 000 : 1. Инкубация посева в термостате позволяет выявить, что количество вносимых микроорганизмов больше в центре пластины в отличие от края. После посева образца с помощью спирального плоттера выросшие колонии считают, используя так называемую сетку для подсчета (рис. 4.3).
Преимущества спирального плоттера: используется меньше агара; меньше чашек, растворителя и пипеток; в течение 1 ч может быть проанализировано в три-четыре раза больше образцов. Прибор в основном используют для исследований таких продуктов, как молоко. Для использования плоттера разработали лазерный счетчик. Высокая стоимость прибора требует его использования для анализа большого числа образцов. Метод описан М.А. Cousin, J.M. Jay и P.C. Vasavada (2001).
Метод спирального посева образцов является широко распространенной в микробиологии техникой, которая была разработана для сокращения количества чашек Петри с питательной средой, используемых для поверхностных посевов. Метод спирального посева позволяет не выполнять серийные разбавления образца, которые необходимы при традиционном способе посева и которые отнимают много времени. Один спиральный посев позволяет сэкономить три чашки питательной среды, что существенно сокращает время операции и расход материалов.
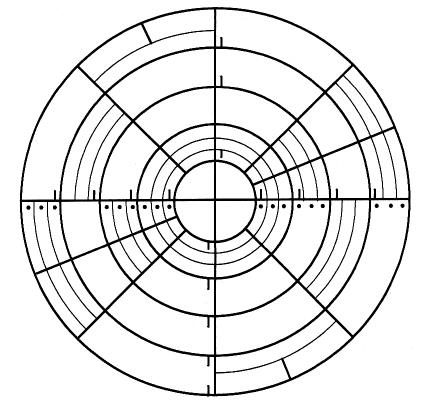
Рис. 4.3.
Сетка для подсчета колоний
Спиральный посев образцов проводится по так называемой Архимедовой спирали. Объем пробы, нанесенной вдоль спирали экспоненциально, уменьшается так, что один посев содержит несколько концентраций образца, распределенных вдоль спирали. После инкубации результат подсчитывают с помощью специальной учетной сетки (вручную) или автоматически с помощью автоматического счетчика колоний.
В приборе Eddy Jet 2 (производитель IUL) реализован новый подход, который заключается в использовании для нанесения материала образца стерилизованных
g-радиацией одноразовых микрошприцев, что предотвращает перекрестную контаминацию. Использование стерильных микрошприцев делает ненужными этапы очистки, что позволяет сэкономить большое количество времени.
Мембраны с размером пор около 0,45 мкм при фильтрации растворенной пробы позволяют задерживать бактерии, но пропускать воду или растворитель. В результате на фильтре накапливаются бактерии. Мембрану помещают на агаровую пластину, содержащую питательный субстрат, и термостатируют. Затем производят подсчет колоний. Такие методы подходят для образцов, содержащих малое число бактерий.
Техника прямого флуоресцентного фильтрования. Подготовленный образец продукта фильтруют, используя фильтр с порами диаметром 5 мкм. Фильтрат обрабатывают тритоном и трипсином для растворения соматических клеток. Затем фильтраты термостатируют и фильтруют через мембраны диаметром 0,6 мкм. Фильтрат окрашивают флуорохромами. В высушенных мазочках подсчитывают клетки с помощью люминесцентного микроскопа. Метод позволяет определять от 6000 КОЕ/г в мясных и молочных продуктах.
4.4. МИКРОСКОПИЧЕСКИЙ ПОДСЧЕТ КОЛОНИЙ
С помощью данного метода подсчитывают микроколонии на питательном агаре, нанесенном на предметное стекло. На предметное стекло наносят суспензию из агара и исследуемого жидкого субстрата. Смесь на стекле термостатируют, высушивают, окрашивают. Методом микроскопии подсчитывают число выросших микроколоний. С учетом объема нанесенной на предметное стекло суспензии (агар + субстрат) и площади распределения на стекле определяют количество выросших колоний в единице объема субстрата.
Петрифильмы. Метод петрифильма (сухих пленок) основан на применении двух пленок, между которыми помещены высушенная питательная среда и желеобразный компонент холодного растворения. Называется этот метод Petrifilm. Петрифильмы – это тесты, используемые для количественного подсчета микроорганизмов в пищевых продуктах. На подложку тестовой системы наносится питательная среда, необходимая для роста конкретного вида или группы микроорганизмов. В питательную среду включено специальное вещество, которое при добавлении жидкости превращается в гель при комнатной температуре. Среда, используемая для роста микроорганизмов, образуется из имеющихся компонентов только в момент посева образца. До этого момента петрифильм не активен и может храниться длительное время. Для сохранения стерильности компоненты питательной среды покрыты сверху непроницаемой пленкой.
Для исследования 1 или 5 мл жидкой суспензии образец помещается между двумя пленками и распределяется в области питания. Метод используется как для аэробного подсчета колоний, так и для индикации и определения количества таксономических групп микроорганизмов.
4.5. НАИБОЛЕЕ ВЕРОЯТНЫЕ ЧИСЛА (НВЧ)
Количество микробиальных клеток определяют методом наиболее вероятных чисел (НВЧ), сущность которого состоит в статистической оценке возможности присутствия живых бактерий в серийных разведениях. Посев проводят из параллельных разведений в жидкую питательную среду, термостатируют и учитывают пробирки, в которых отмечается рост бактерий. Метод НВЧ статистически неэффективен, поскольку каждая пробирка соответствует только небольшой части поверхности чашки Петри. В связи с этим приходится использовать много пробирок либо удовлетвориться весьма приблизительным результатом.
Одним из преимуществ метода НВЧ является возможность его использования в отсутствие способа культивирования бактерий на твердой среде. Второе его преимущество заключается в том, что он удобен в случае высокой вариабельности кинетики роста.
Предположим, что некоторые клетки из смешанной культуры растут быстро, образуя на агаре крупные колонии, которые, распространяясь по поверхности, маскируют появляющиеся позже мелкие колонии интересующего нас микроорганизма. Хотя количество таких мелких колоний по сравнению с крупными может быть больше, их невозможно учесть на чашках из-за присутствия колоний более подвижных или быстрее растущих бактерий. Третье преимущество метода НВЧ состоит в том, что в присутствии не представляющих интереса организмов и в отсутствие подходящего метода селекции его можно использовать для выявления легко обнаруживаемых продуктов (например, пигментов или антибиотиков), продуцируемых изучаемыми микроорганизмами.
Наконец, метод НВЧ используют, если агар или другие отвердители содержат некоторые факторы (например, тяжелые металлы), которые изменяют достоверность подсчета или взаимодействуют с изучаемыми бактериями.
4.6. ВОССТАНОВЛЕНИЕ КРАСИТЕЛЕЙ
Метод применяют для определения количества живых микроорганизмов. С его помощью устанавливают биохимическую активность микробов, продуцирующих фермент редуктазу, которая способна обесцвечивать некоторые краски, в частности метиленовую синь и резазурин. В основу метода положено определение времени, необходимого для обесцвечивания метиленовой сини. Преимущество метода редуктазной пробы в сравнении с прямым бактериологическим методом состоит в быстроте получения результата (примерно через 5,5 ч). Однако не все микроорганизмы обладают редуцирующей активностью. В большей степени этим свойством обладают молочнокислые стрептококки, кишечные палочки, маслянокислые и гнилостные бактерии, в несколько меньшей степени – сальмонеллы и стафилококки. Редуктазная проба с метиленовой синью дает неточное представление о степени бактериальной обсемененности продукта и его санитарном качестве. Поэтому показатели редуктазной пробы необходимо учитывать в комплексе с другими результатами исследований.
Преимущество резазурина состоит в том, что он обладает высоким окислительно-восстановительным потенциалом, что ускоряет исследование. На показатели резазуриновой пробы температура продукта не оказывает заметного влияния.
4.7. ПРЯМОЙ МИКРОСКОПИЧЕСКИЙ ПОДСЧЕТ
Чтобы определить общее количество микроорганизмов в различных материалах, применяют методы прямого подсчета клеток под микроскопом (в специальных счетных камерах, в фиксированных мазках, на мембранных фильтрах). Такие методы широко применяются в исследованиях микрофлоры воды и почвы.
Эффективность такого подсчета, как правило, в 10–10 000 раз выше, чем подсчета методом высева, так как многие микроорганизмы не растут на питательных средах и учесть их можно только под микроскопом. Метод позволяет получить дополнительную информацию о размерах и морфологии изучаемого объекта. Кроме того, прямой подсчет микроорганизмов осуществляется быстрее, он дешев, а оборудование для его осуществления имеется в каждой лаборатории.
Подсчет клеток в окрашенных препаратах (метод Виноградского–Брида). Преимущество метода заключается в том, что фиксированные окрашенные препараты хорошо сохраняются и подсчет можно проводить в удобное для исследователя время.
Техника осуществления подсчета:
- на хорошо обезжиренном предметном стекле маркером рисуют прямоугольник строго определенной площади (2, 4 или 6);
- на стекло в прямоугольник микропипеткой (или автоматической пипеткой) наносят определенный объем суспензии клеток (0,01; 0,02 или 0,03 мл);
- суспензию равномерно распределяют петлей по всей площади прямоугольника;
- препарат высушивают на воздухе и фиксируют 15 мин 96%-м этанолом;
- проводят окрашивание препарата фуксином Циля (в течение 1–2 мин);
- краситель сливают, препарат промывают водой, последовательно погружая стекло в 5–6 стаканов с водой, и высушивают на воздухе.
Количество клеток микроорганизмов подсчитывают, используя иммерсионный объектив, в квадратах окулярной сетки, которую помещают в окуляр между собирательной и глазной линзами. При отсутствии сетки подсчитывают число клеток в поле зрения микроскопа.
Площадь квадрата сетки или поля зрения определяют с помощью объект-микрометра. Последний помещают на столик микроскопа вместо препарата и при том же увеличении, при котором проводили подсчет, определяют длину стороны квадрата окулярной сетки или диаметр поля зрения.
Для получения достоверных результатов клетки микроорганизмов рекомендуется подсчитывать не менее чем в 50–100 полях зрения, а общее количество подсчитанных клеток не должно быть менее 600.
Количество клеток микроорганизмов, содержащихся в 1 мл исследуемого материала, вычисляют по формуле
M = (AS/Vs)·n
где М – количество клеток в 1 мл; А – среднее число клеток в квадрате окулярной сетки (поле зрения); s и S – площадь квадрата окулярной сетки (поля зрения) и приготовленного мазка в мкм2 соответственно; V – объем нанесенной на стекло суспензии, мл; n – разведение исследуемого материала.
4.8. МИКРОБИОЛОГИЧЕСКАЯ ОЦЕНКА ПОВЕРХНОСТЕЙ
Существующие методы микробиологической оценки поверхностей не позволяют собирать все микроорганизмы. Тем не менее их использование на пищевых предприятиях может обеспечивать получение ценной информации. Очевидно, что в пробах не могут быть представлены все микроорганизмы.
Например, для исследования микроорганизмов, имеющихся на поверхности мяса, обожженное предметное стекло прижимают к мясу, чтобы получить отпечаток с его поверхностных слоев. Готовые отпечатки, полученные таким способом, фиксируют над пламенем спиртовки и окрашивают по Граму. Готовые препараты рассматривают под микроскопом с иммерсией, подсчитывая количество бактерий в поле зрения и записывая их форму. Исследуют не менее 10 полей зрения. Подсчитывают отдельно грамположительные и грамотрицательные клетки и определяют среднее количество клеток.
Смывы. Их берут стерильными увлажненными ватно-марлевыми тампонами объемом 5–7 см3, удерживаемыми стерильным пинцетом, или ватными, марлевыми тампонами, закрепленными на стержне из проволоки или дерева.
Тампоны стерилизуют завернутыми в бумагу. В случае закрепления тампона на металлической или деревянной палочке, пропущенной через ватную пробку, его вставляют в пробирку с 10 см3 смывной жидкости (водопроводной воды, физраствора, пептонной воды) или таким же количеством жидкой питательной среды для обнаружения БГКП (среда Кода, Кесслер, Хейфеца и др.). Тампон не должен касаться жидкости. Все вместе стерилизуют при (121 ± 1)°С в течение 30 мин. Современные методы позволяют пользоваться готовыми наборами стерильных сред и тампонов на палочках.
Непосредственно перед взятием смыва тампон на палочке увлажняют, наклоняя пробирку или опуская тампон вниз. Тампоны без палочки, находящиеся в стерильной чашке Петри, увлажняют стерильной смывной жидкостью из расчета 10 мл на 1 тампон. Смывы крупного оборудования и инвентаря берут с поверхности 100 см2. При взятии смывов с ровной поверхности используют металлические рамки-трафареты, ограничивающие площадь 100 см2. Перед каждым употреблением трафарет обжигают.
После взятия смыва тампон без палочки погружают либо в пробирку со средой для БГКП, либо в пробирку со смывной жидкостью, используемой в дальнейшем для посевов на питательные среды.
Смывы мелких объектов (поверхность которых < 100 см2) берут со всей поверхности.
После взятия смыва пробку с тампоном на палочке вновь вставляют в пробирку так, чтобы тампон погрузился в смывную жидкость или жидкую питательную среду для БГКП. Посевы термостатируют при (37 ± 1)°С в течение 18–24 ч. В случае помещения тампона в смывную жидкость после тщательного перемешивания она является исходным материалом для посева.
Для определения чистоты рук работников, которые непосредственно соприкасаются с чистым оборудованием или продукцией, смоченным тампоном тщательно обтирают обе ладони и пальцы. Исследования смывов проводят не реже двух раз в месяц. Контроль обработки рук проводится перед работой, после туалета, при переходе с одного участка на другой.
Для сбора материала смыва с одной поверхности изготавливают стерильные трафареты с отверстиями конкретного размера, которые обрабатывают тампоном, например, 1 дм2 или 1 см2.
После наложения стерильного шаблона поверхность, выступающую в отверстии шаблона, протирают тампоном. Тампон возвращается в его держатель (пробирку), содержащий соответствующий растворитель, и хранится при температуре холодильника до посева. Растворитель, если необходимо, должен содержать нейтрализатор дезинфектанта.
Микроорганизмы подсчитывают методом стандартного подсчета колоний.
Посев отпечатком. Метод прямого посева микроорганизмов отпечатком на агаре предполагает использование чашек Петри. Их заполняют 15–16 мл плотной среды, которая после затвердевания создает агаровую пластинку. Чашки опрокидывают. Соприкасаясь с объектом исследования, агаровая плотная среда соприкасается с исследуемой поверхностью. После термостатирования засеянной таким образом чашки Петри в ней подсчитывают число колоний.
В опыте с исследованием поверхности металла, обсемененного спорами Bacillus subtilis, споры были обнаружены методом отпечатков более чем в 40% случаев, а методом смыва – в 50%.
Методы «агаровых колбасок». Этот метод предполагает использование модифицированного шприца для инъекций. У 100-миллилитрового шприца отрезают вместе с канюлей дно и получают полый цилиндр, который заполняют агаром. Поршнем выдвигают столбик агара до конца цилиндра и прикасаются им к исследуемой поверхности. Сверху столбик агара отрезают и помещают в чашку Петри, термостатируют и подсчитывают число колоний. Методику применяют для анализа микробиоты на поверхности мяса и растений. Так как скопления микроорганизмов образуют одну колонию, полученное методом «агаровых колбасок» количество микроорганизмов меньше, чем методами с использованием пробоподготовки, которые позволяют дезинтегрировать скопления бактерий.
Другие поверхностные методы.
Липкая пленка. Ее приклеивают к исследуемой поверхности, затем контактировавшей стороной накладывают на агаровую пластинку. Данный метод менее эффективен, чем метод снятия смывов, но с успехом используется в оценке количества микроорганизмов на поверхности мяса.
Аэрозольная пушка. Метод основывается на нанесении аэрозоля промывного раствора на ограниченную область поверхности и последующем посеве промывного раствора на чашку. Для него необходим источник давления воздуха. Для смыва микроорганизмов с различных поверхностей методика аэрозольной пушки значительно эффективней тампонового метода.
4.9. ТРАВМИРОВАННЫЕ ФОРМЫ БАКТЕРИЙ И РЕАКЦИЯ НА СТРЕССОВЫЕ ВОЗДЕЙСТВИЯ
Множество физических и химических факторов могут оказывать неблагоприятное действие на бактериальную клетку. Токсические вещества, неблагоприятная температура, рН, облучение в пределах видовой чувствительности организма не препятствуют существованию бактерий. Существенные изменения условий в неблагоприятную сторону приводят к отмиранию клеток. При некоторых воздействиях, которые обычно обозначают как сублетальные, клетки не погибают сразу, но оказываются травмированными. Их дальнейшая судьба в значительной степени зависит от условий, в которых они окажутся. У них во многих случаях нарушаются барьерные функции мембран, наблюдается выход в среду некоторых метаболитов, нарушается синтез белка, возникают нарушения в структуре ДНК. Условия, вполне благоприятные для развития нетравмированных бактерий, могут быть гибельными для травмированных клеток. Бактерии, подвергнутые ряду воздействий, гибнут на средах с повышенной концентрацией солей, совершенно не опасных для нормальных клеток, или на средах с поверхностно-активными соединениями, также в концентрациях, не влияющих на рост нормальных клеток. Эти факторы иногда определяют как селектирующие здоровые клетки от травмированных. В качестве таких факторов могут выступать рН, температура, даже определенные пищевые субстраты.
Травмированные клетки, помещенные в благоприятные условия, способны репарировать, т.е. исправлять повреждения различных структур. Внимание исследователей в последнее время привлечено к изучению механизмов восстановления повреждений ДНК. Что же касается репараций повреждений других структур клетки, то их механизмы еще мало изучены. Известно, что для репарации функций мембран требуется значительное время, и их восстановление связано с синтезом белка и РНК, а иногда необходим синтез фосфолипидов. В различных случаях благоприятные для репарации условия могут в корне различаться. Например, иногда репарация идет лучше в богатых, а иногда в бедных средах. Это справедливо и для репарации повреждений ДНК.
Известен ряд систем репарации повреждений ДНК. Эти системы специфичны в отношении не тех или иных воздействий, а определенных нарушений структуры ДНК.
Прямая фотореактивация. Она наблюдается при освещении клеток видимым или ближним УФ-светом и состоит в разрезании пиримидиновых димеров в ДНК. Последние возникают обычно при воздействии на клетки среднего или дальнего УФ-света, поэтому особое значение фотореактивация имеет именно при его воздействии. Процесс фотореактивации связан с действием фермента фотолиазы, которая связывается с пиримидиновыми димерами. Активация фермент-субстратного комплекса светом с длиной волны
300–600 нм приводит к мономеризации димеров.
Непрямая фотореактивация. Она имеет пик облучения в области 340 нм. Снижение эффекта УФ-облучения в этом случае объясняется задержкой роста бактерий, в результате чего удлиняется период протекания репарационных процессов. Непрямая фотореактивация, таким образом, не связана с работой каких-либо специальных репарационных систем.
Эксцизионная репарация. Она состоит в удалении поврежденного участка ДНК одной цепи и восстановлении нормальной последовательности оснований по матрице оснований на комплементарной цепи. Вырезание повреждений осуществляется непосредственно эндонуклеазой, которая узнает нарушения. У Е. coli эта функция выполняется комплексом эндуклеаз, кодируемых генами uvr А, uvr В, uvr С.
Рекомбинационная репарация включает рекомбинацию двух типов. При рекомбинации первого типа заполняется пробел в последовательности оснований во вновь синтезированной цепи ДНК на месте поврежденного участка. При рекомбинации второго типа осуществляется восстановление двунитевых разрывов в ДНК, возникающих под действием УФ-света, ионизирующей радиации, других повреждающих факторов.
Травмированные клетки восстанавливают причиненные им повреждения, и под влиянием сублетальных воздействий неблагоприятных факторов происходят перестройки в процессах метаболизма клетки, имеющие очевидное адаптивное значение. Более того, оказывается, что воздействие неблагоприятных условий нередко вызывает ответную реакцию клетки, еще не приводя к каким-либо нарушениям ее структуры.
Клетки, подвергшиеся неблагоприятным воздействиям, находятся в состоянии стресса. В различных случаях это состояние может быть связано или не связано с нарушениями клеточных структур, т.е. клетки могут быть или не быть травмированы. В современной микробиологической литературе термины «стресс» и «стрессор» используются очень широко.
Процессы, протекающие в клетках, находящихся в состоянии стресса, изучены преимущественно на модели кишечных бактерий, прежде всего Е. coli и Salmonella typhimurium.
В зависимости от природы стрессора и характера причиненных повреждений реакция клетки может быть различной. К настоящему времени у бактерий выявлено пять регуляторных систем ответа на стрессовые воздействия: 1) «строгий контроль»; 2) SOS-ответ; 3) адаптивный ответ; 4) синтез белков теплового шока; 5) ответ на окислительный стресс. Во всех случаях происходят глубокие перестройки метаболизма, связанные с замедлением или прекращением размножения и синтезом белков, необходимых для выживания. В некоторых случаях в процессах регуляции принимают участие специальные соединения – клеточные гормоны, названные алармонами (от фр. Alarme – тревога). Перечисленные системы находятся под контролем соответствующих генов и взаимосвязаны.
Система строгого контроля включается в ответ на исключение из среды необходимых клетке аминокислот, источника углерода, солевой шок, падение температуры (по крайней мере у некоторых термофильных бактерий). В данном случае клетки необязательно должны быть травмированы. Система строгого контроля регулируется продуктом гена rel А посредством синтетазы алармонов. У разных бактерий свойства этого фермента могут несколько различаться. Повышение содержания алармонов в результате активности синтетазы приводит к ингибированию синтеза иРНК, тРНК и некоторых рРНК, в результате снижается синтез фосфатидилэтаноламина, а соответственно и мембранных липидов, снижается синтез нуклеотидов. Снижение уровня метаболизма способствует выживанию клетки в условиях, не допускающих сбалансированного обмена.
Система SOS-ответа включается при разнообразных нарушениях в структуре ДНК или в системах ее репликации. Эта система работает, например, после УФ-облучения, воздействия различными химическими мутагенами. Белок Ree А, активированный сигналом-индуктором SOS-системы, приобретает свойства протеазы и инактивирует репрессорный белок Lex А. В результате разрушения белка Lex А снимается репрессия по крайней мере с 17 генов. Белок Ree А также участвует в рекомбинации и в процессах репарации ДНК.
При SOS-ответе функционирует также пострепликативная система репарации, при которой повышена частота мутаций. Ген umu С, также репрессируемый Lex А, определяет индуцированный мутагенез. Можно предположить, что стимуляция мутагенеза в процессе SOS-ответа имеет приспособительное значение – могут появиться мутанты, более приспособленные к условиям, индуцировавшим SOS-ответ.
Наличие SOS-системы обнаружено у различных представителей семейства Enterobacteriaceae – Streptococcus faecalis, Bacillus subtulis. У последней при SOS-ответе, кроме всего прочего, развивается компетентное состояние клеток, т.е. они приобретают способность воспринимать экзогенную ДНК в процессе генетической трансформации.
Система адаптивного ответа – это индуцибельная антимутагенная система репарации. Облучение и мутагены в низких дозах вызывают снижение частоты мутаций при последующих воздействиях. Например, облучение в дозе 12,5–50 рад может проявить защитный эффект в отношении последующего массированного облучения в дозах порядка 2–103 рад. По мере инкубации в присутствии мутагена частота мутаций падает. Индукция системы происходит при концентрациях мутагенов в 10–100 раз меньших, чем необходимые для проявления их мутагенного действия.
Синтез белков теплового шока (БТШ) возникает при сублетальном температурном шоке. При этом наблюдается быстрое изменение скорости синтеза большинства из 1000 белков, выявляемых в клетках бактерий. Синтез некоторых белков прекращается, тогда как синтез БТШ усиливается более чем в 20 раз. У Е. coli выявлено 14 основных белков теплового шока. Ген теплового шока htp R необходим бактериям для роста при повышенной температуре, например, для роста Е. coli при 42°С, но этот ген не нужен для роста при умеренной температуре. Независимо от продукта гена htp R тепловой шок приводит к угнетению синтеза белка. Синтез БТШ может быть вызван также воздействием этанола, УФ-облучения, вирусной инфекции.
Ответ на окислительный стресс. Клетки экспоненциально растущей культуры S. typhimurium, обработанные в течение 1 ч 60 мМ перекисью водорода, приобретают устойчивость к 10 мМ перекиси; для необработанных клеток такая концентрация перекиси летальна. Как и ответы на другие стрессорные воздействия, система ответа на окислительный стресс находится под контролем специального гена – в данном случае оху R. Клетки, приобретшие устойчивость к перекиси, становятся устойчивыми и к тепловому шоку, однако тепловой шок не стимулирует устойчивости к перекисям. Среди белков, синтез которых стимулируется в условиях окислительного стресса, имеются и ферменты, участвующие в процессах репарации ДНК, поскольку окислители вызывают ее специфические повреждения.
После воздействия на бактерии экологических стрессов часть клеток становится подверженной метаболическому шоку, вызывающему неспособность образовывать колонии на элективных средах. Избежавшие стресса клетки остаются нечувствительными.
Условия репарации повреждений. Поврежденные клетки, например S. aureus, восстанавливаются в питательных средах при температуре около 15°С, но не ниже 10°С. Процесс восстановления не мгновенен, а происходит поэтапно. Сохранение клеток от повреждений повышенной температурой и замораживания поддерживается сложными питательными средами и составом или некоторыми определенными их компонентами. Молоко обеспечивает большую сохранность, чем физиологический раствор или смесь аминокислот.
Показано, что травмированные высокой температурой споры С. perfringens приобретают повышенную чувствительность к антибиотикам.
На питательных средах, содержащих пируват, получены большие количества клеток, поврежденных разнообразными агентами.
Поврежденные радиацией споры Clostridium botulinum не способны расти при низкой температуре. Радиационное повреждение восстанавливается на специальных средах – телурит-полимиксиновом желточном агаре.
При резком изменении условий существования микроорганизмы с помощью различных сенсорных и регуляторных механизмов перестраивают работу своего генетического аппарата, что позволяет им сохранять свою жизнеспособность. Но что происходит, если крайне неблагоприятные условия сохраняются и индукция стрессовых генов не в состоянии спасти клетку? До последнего времени считалось, что у грамотрицательных бактерий следующей стадией является гибель клетки. Но в последние годы появилось достаточно экспериментальных данных, дающих основание утверждать, что следующей «крайней мерой» в реакции грамотрицательных бактерий является переход в состояние «спячки», выражающейся во временной потере их воспроизводимости. У грамотрицательных бактерий морфологически дифференцированные структурные образования, подобные эндоспорам бацилл, не обнаружены, однако в настоящее время накоплено достаточно данных, свидетельствующих о способности неспорообразующих бактерий к длительному существованию во внешней среде в виде клеток со значительно сниженной метаболической активностью, не обнаруживаемых традиционными методами лабораторного культивирования на питательных средах. Подобное состояние покоя с временной потерей воспроизводимости у грамотрицательных бактерий, впервые обнаруженное в лаборатории R. Colwell, было предложено называть некультивируемым (НС), а сами бактерии в таком состоянии некультивируемыми формами (НФ). В настоящее время способность к переходу в некультивируемое состояние обнаружена у множества бактерий.
Ниже представлен неполный перечень бактериальных видов, для которых к настоящему времени продемонстрирована способность к переходу в HC: Enterobacter aerogenes, Enterococcus faecalis, Escherichia coli, Klebsiella pneumonia, Legionella pneumophila, Listeria monocytogenes, Pseudomonas putida, Salmonella enteritidis, Salmonella typhimurium, Shigella dysenteria, Vibrio chalerae и др.
Значимость некультивируемых форм бактерий. Феномен существования жизнеспособных бактерий в НС имеет серьезное значение для санитарной микробиологии, поскольку установлено, что НФ патогенных, условно патогенных и токсигенных бактерий сохраняют свои вирулентные свойства. Прямые доказательства вирулентности НФ бактерий получены при введении инокулята V. cholerae и энтеротоксигенных E.coli в перевязанную петлю кишечника кролика. НФ Legionella Pneumophilia так же, как и нормальные вегетативные клетки, высевались из желточного мешка при их инокулировании в куриные эмбрионы. Надо отметить, что пассажи НФ через организм чувствительного животного являются в большинстве случаев наилучшим способом рекультивации или вывода бактерий из НС. Вероятно, в этом случае бактерии попадают в условия, благоприятные для активного деления, а именно: оптимальная температура, богатая и сбалансированная смесь ростовых субстратов. Было показано, что введение культур двух вирулентных штаммов S. typhimurium, находящихся в НС в течение трех месяцев, внутрибрюшинно беспородным мышам привело в одном случае к гибели животных, а во втором – к выделению культуры из их селезенки и печени. В обоих случаях штаммы были маркированы, что позволило легко отличить их от любого дикого штамма, случайно вызвавшего заболевание. Поскольку в данном случае не определяли точно дозу заражения НФ, довольно трудно оценить LD-50. Однако приблизительная оценка количества некультивируемых клеток методом ПЦР позволяет считать, что LD-50 в случае НФ несколько выше, чем при заражении культивируемыми клетками тех же штаммов. Это может свидетельствовать либо о некотором ослаблении вирулентных свойств, либо о том, что не все некультивируемые клетки сохраняют способность к рекультивации. Одновременное использование других лабораторных приемов рекультивации НФ указанных штаммов, а именно: перенесение их в богатую питательную среду, повышение температуры инкубации до 37°С, кратковременный тепловой шок, облучение слабыми дозами УФ-света не дали положительных результатов. Аналогичные сведения рекультивации НФ разных видов бактерий в лабораторных условиях имеются в научной литературе.
В настоящее время роль НФ в сохранении вирулентных штаммов в объектах внешней среды и пищевых продуктах продемонстрирована для возбудителей сапронозов – иерсиний и листерий.
В некоторых случаях результаты индикации микроорганизмов из пищевых продуктов показывают отсутствие какого-либо количества колониеобразующих единиц (КОЕ) или их количество значительно ниже, чем фактическое. Это можно расценить как результат метаболического повреждения клеток, как описано выше. Но некультивируемые клетки находятся в состоянии, которое отличается от состояния поврежденных клеток. Метаболически поврежденные клетки будут восстанавливаться при их культивировании на неселективной среде, не содержащей ингибиторов, тогда как клетки жизнеспособные, но некультивируемые – нет.
Контрольные вопросы и задания
- Перечислите и охарактеризуйте четыре метода исследования оценки общей численности микроорганизмов.
- Назовите сущность и способы пробоподготовки.
- Назовите сущность и способы гомогенизации. Опишите принцип действия гомогенизаторов.
- Изложите сущность метода стандартного подсчета колоний (СПК).
- Опишите работу спирального плоттера.
- Поясните, как используются мембранные фильтры, в том числе путем введения флуоресцентного окрашивания.
- Опишите методы микроскопического подсчета колоний: метод агаровых капелек, петрифильмы.
- В чем сущность методов наиболее вероятного числа и восстановления красителей?
- Укажите особенности метода прямого микроскопического подсчета.
- В чем сущность методов микробиологической оценки поверхностей: смывов, посевов отпечатков, «агаровых колбасок», липкой пленки, аэрозольной пушки?
- Раскройте сущность и значимость репаративных свойств бактерий и некультивируемых форм бактерий.

