Среди других микроорганизмов, которые широко распространены в природе и являются возбудителями пищевых отравлений человека, следует выделить В. cereus, Cl. perfringens, Cl. botulinum, CI. difficile, а также вирус гепатита E.
Они могут контаминировать пищевое сырье и продукцию, в том числе полученную от здоровых убойных животных, находясь на поверхности их волосяного покрова, копыт или содержимого желудочно-кишечного тракта.
Актуальность всестороннего изучения этих микроорганизмов, а также мер профилактики пищевых отравлений, которые они вызывают, неоднократно рассматривались на экспертных комитетах ВОЗ по микробиологическим проблемам пищевой гигиены.
BACILLUS CEREUS
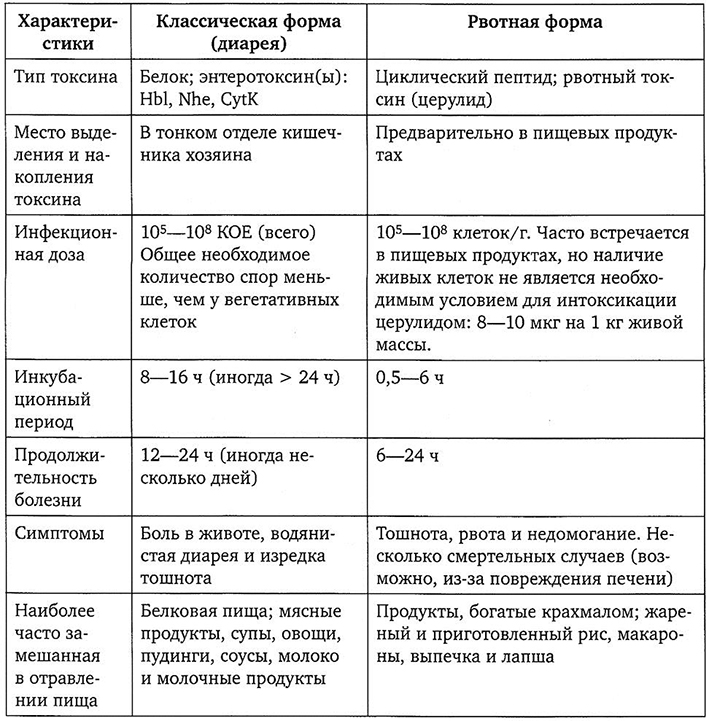
В. cereus — аэробный спорообразующий микроорганизм, который вызывает пищевые отравления средней тяжести, продолжительностью 12-24 ч. Они проявляются в двух выраженных формах — классической и с преобладанием рвотного синдрома (табл. 4.1). Классическая форма имеет средний инкубационный период 10-13 ч и характеризуется симптомами острого энтероколита (абдоминальные боли, профузная диарея, слабая тошнота).
Вторая форма отравления имеет более короткий инкубационный период (от 1 до 5 ч) и характеризуется симптомами острого гастрита и гастроэнтерита, при которых тошнота и рвота являются доминирующими симптомами (похожа по клинической картине на стафилококковую интоксикацию).
В настоящее время идентифицировано 18 различных серотипов В. cereus. При этом, классический тип отравления вызывается серотипами 2, 6, 8, 9 и 10, а «рвотный» — 1, 3, и 5.
Вместе с тем установлено, что спектр потенциальной токсичности В. cereus варьирует от штаммов, используемых в качестве пробиотиков для человека, до высокотоксичных штаммов, которые, как сообщается, ответственны за гибель людей, связанных с пищевыми продуктами.
Bacillus cereus может быть выделен из большого ассортимента различных пищевых продуктов и пищевых ингредиентов, включая рис, молочные продукты, специи, сушеные продукты и овощи.
Таблица 4.1
Краткая характеристика двух форм пищевых отравлений, вызываемых Вас. cereus [3]
Перекрестное загрязнение может распространять споры или клетки в других продуктах питания, таких как мясные продукты. Во время сбора урожая клетки или споры В. cereus могут с сырьем растительного происхождения попадать на пищевые перерабатывающие предприятия, накапливаться на пищевом оборудовании. Споры В. cereus зачастую не удаляются путем регулярной очистки поверхностей. Кроме того, доказана способность В. cereus формировать биопленки. Это свойство, видимо, очень важно для обеспечения его устойчивости в технологическом оборудовании на предприятиях пищевой промышленности, особенно в молочных трубопроводах. Биопленка защищает споры и вегетативные клетки от инактивации дезинфицирующими средствами.
Современная технология крупномасштабного производства пищевых продуктов с достаточно широким использованием охлаждения в качестве средства предохранения от порчи создала условия хорошо подходящую для бактерий, которые не очень конкурентоспособны, но могут выдержать термическую обработку, а также расти при низких температурах. В. cereus и другие виды Bacillus часто выделяют из молочных продуктов и сред, в которых широко используется охлаждение в качестве средства контроля роста микроорганизмов. Другие продукты, прошедшие небольшую термообработку с длительным хранением в холодильнике, также представляют новую и благоприятную среду для В. cereus.
Принимая во внимание повсеместное распространение В. cereus, наличие спор, любой пищевой продукт с рН > 4,8 можно рассматривать как потенциальный источник пищевого заболевания. Несоблюдение потребителями основных правил приготовления пищи, т. е. медленное или неадекватное охлаждение, хранение при температуре окружающей среды или длительное поддержание температуры менее 60 °С, может привести к росту В. cereus и, как правило, к пищевому заболеванию.
Классическая форма пищевого отравления, вызванного Вас. cereus, известна с начала XX в., но первое детальное описание отравления было представлено в 1950 г. Оно имело место в Норвегии и общее количество больных составило 600 человек. В. cereus в количестве 2-Ю9/ мл было выделено из пищи, употребляемой пострадавшими.
В дальнейшем подобные вспышки пищевых отравлений были отмечены в странах Западной и Восточной Европы. К настоящему времени описано семь крупных вспышек (с числом заболевших более 50 человек и (или) больше чем с одним зарегистрированным летальным исходом).
В Венгрии в промежутке между 1960-1968 гг. пищевые отравления, вызываемые В. cereus, занимали третье место среди других пищевых интоксикаций. При этом было установлено, что наиболее часто причиной пищевых отравлений, вызванных данным микроорганизмом, являлись мясные продукты (вареное мясо и птица), вареные овощи и десертные блюда, иногда — рыба, мороженое и молоко, а также специи.
В США впервые пищевое отравление, вызванное В. cereus, было зарегистрировано в 1969 г. Крупные вспышки пищевых интоксикаций, вызванные Вас. cereus, были отмечены в начале 1980-х гг. в Австралии, Канаде и Нидерландах, в Великобритании. Многие из них были вследствие потребления вареного или жареного риса, приготовленного за несколько часов или даже дней до потребления (рис. 4.1). При эпидемиологическом расследовании было выявлено, что В. cereus часто присутствует в сыром рисе. Так, из 108 исследованных образцов сырого риса в 98 была выделена культура В. cereus. Процесс кулинарной обработки риса (варка) не убивает споры В. cereus, которые могут прорастать и быстро размножаться в процессе охлаждения большой массы проваренного риса. Определенный риск представляют также сухие продукты питания из группы бобовых и злаковых, которые нуждаются в предварительном замачивании перед термической обработкой. В этот период может идти быстрое размножение В. cereus.
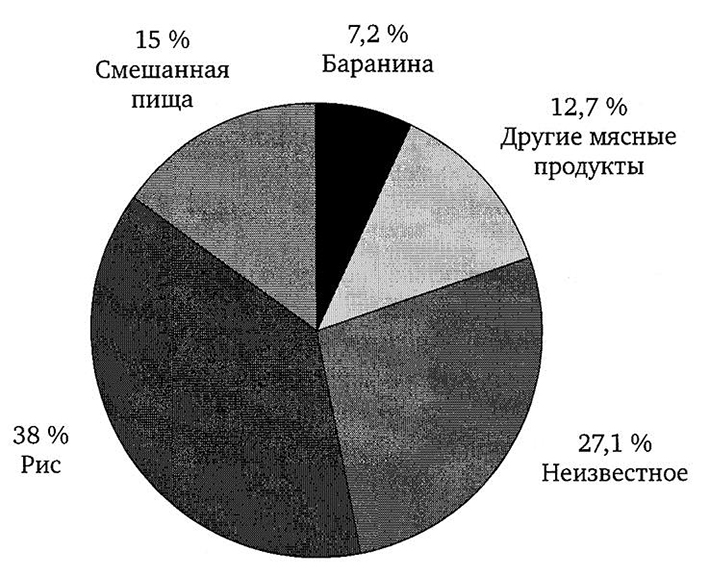
Рис. 4.1 Факторы передачи В. cereus в Великобритании [14]
В настоящее время микроорганизм хорошо изучен. В. cereus представляет собой грамположительные крупные спорообразующие аэробные палочки. Имеет тесное родство с возбудителем сибирской язвы. Широко распространен во внешней среде. Его можно обнаружить в почве, пыли, воде. Споры могут пассивно распространяться и, таким образом, обнаруживаться также вне естественных мест обитания. Учитывая то, что В. cereus, находящийся во внешней среде преимущественно в виде спор, при благоприятных условиях прорастает в вегетативные клетки и размножается (особенно это характерно для богатых органическими веществами почвах), его относят к сапрозоонозам. Кроме того установлено, что В. cereus, часто выделяют из кишечника насекомых.
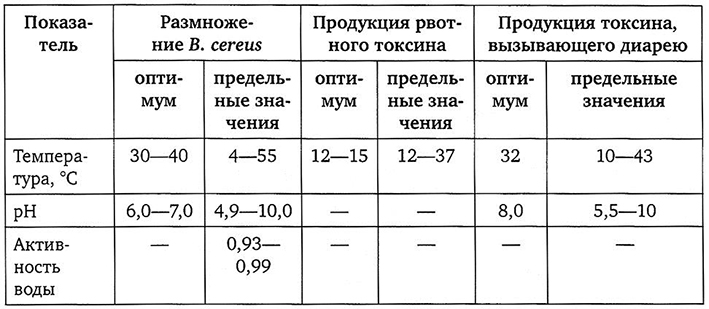
Что касается условий роста и устойчивости во внешней среде, то они широко варьируются у различных штаммов В. cereus (табл. 4.2).
Все изоляты, выделенные из продуктов питания и от человека, можно разделить на мезофильные и психрофильные. Мезофильные штаммы хорошо растут при 37 °С, но не растут ниже 10 °С; психрофильные штаммы хорошо растут при температурах 4-10 °С, но плохо растут при 37 °С. Штаммы В. cereus, связанные с продукцией рвотного токсина, были мезофилами. В пищевых продуктах с низкой кислотностью (рН более 4,8) споры В. cereus выдерживают воздействие температуры 100 °С в течение 5 мин. Доза радиации, необходимая для уничтожения спор, находится в пределах 2000-3000 Крад.
Рост вегетативных клеток в пищевых продуктах зависит от показателя активности воды среды aw, который колеблется в пределах 0,98-0,93. Диапазон рН для роста на питательных средах составляет 4,9-9,3. Однако в некоторых пищевых продуктах (например, в мясе и рисе), организм может размножаться при рН 4,35.
Таблица 4.2
Влияние некоторых факторов внешней среды на В. cereus [16]
Вегетативные клетки В. cereus довольно чувствительны к воздействию химических агентов. Так, при достижении концентрации озона в воде 0,1 мг/л наступает гибель 99,9 % клеток этого организма, что сравнимо с устойчивостью к озону кишечной палочки.
Механизм патогенности В. cereus изучен недостаточно детально. Относительно краткий инкубационный период, незначительная продолжительность заболевания и отсутствие повышенной температуры тела позволяют считать, что пищевое отравление, вызываемое В. cereus, связано с интоксикацией. Ассоциированный с клетками В. cereus энтеротоксин выделяется во время их лизиса. Он чувствителен к трипсину и проназе, инактивируется при температуре 56 °С в течение 30 мин и наиболее стабилен при рН 5,0-10,0.
Используя технику изолированной кишечной петли, удалось показать, что токсин В. cereus вызывает накопление эксудата в перевязанном сегменте кишечника кролика, некротическую реакцию без отека при внутрикожном введении у морских свинок и диарею при оральном введении обезьянам. Как уже отмечалось, наряду с указанным выше токсином В. cereus может вырабатывать «рвотный» токсин. Последний является термостабильным (при 126 °С инактивируется через 90 мин) и может накапливаться при замачивании пищевых продуктов в воде (например, бобовых). Размножаясь в пище при благоприятных условиях, В. cereus выделяет три экстрацеллюлярные субстанции: лецитиназу, гемолизин и летальный токсин (для мышей).
Взаимосвязь между этими субстанциями и энтеротоксином не совсем ясна. Однако отмечено их быстрое накопление в пищевых продуктах. Некоторые особо вирулентные штаммы В. cereus не только способны накапливать токсин в пище, но и, попав в ослабленный организм человека (особенно грудных детей), могут размножаться в желудочно-кишечном тракте и вызывать энтеротоксемию.
Следует иметь в виду, что В. cereus вызывает отравления, только когда в пище присутствует большое количество микробных тел (более 106/г).Поэтому подсчет клеток В. cereus в пищевых продуктах может оказать существенную помощь при оценке их безопасности.
При пищевом отравлении классического типа В. cereus выделяется с фекалиями пациентов в незначительных количествах. Однако если отравление «рвотного» типа, то микроорганизм выделяется в большом количестве (до 109/г). Для выделения и подсчета данного микроорганизма используют кровяные агары или маннитол-желточно-полимиксиновый агар.
Специфических способов лечения пищевых отравлений, вызываемых В. cereus, нет. Антибиотики в этом случае неэффективны. Основное внимание должно уделяться профилактике инфекции, так как бациллы убиквитарны и в малых количествах не представляют опасности для здоровья человека.
Основное внимание должно быть направлено на создание неблагоприятных условий для прорастания спор, попавших в пищевые продукты и угнетение возможного размножения вегетативных клеток (температура ниже 10 °С и выше 56 °С).
CLOSTRIDIUM PERFRINGENS
Микроорганизм CI perfringens известен уже около 50 лет как один из важных возбудителей пищевых отравлений. Наиболее выраженные симптомы отравлений — сильная диарея и боль в нижней области живота спустя 8-24 ч после употребления пищи. Микроорганизмы обнаруживаются в фекалиях человека и животных, в почве и сырых пищевых продуктах.
В связи с широким распространением в природе, CI. perfringens может контаминировать различные пищевые продукты, но чаще всего продукты животного происхождения. Говядина, свинина и содержащие их продукты наиболее часто становятся факторами передачи инфекции. За ними следуют продукты из птицы, включая индейку и кур, баранина и другие продукты животного происхождения (рис. 4.2).
Существует пять серогрупп CI. perfringens — А, В, С, D, Е (типы А, С, D — патогенны для человека, а В, С, D и Е — патогенны для животных). Свыше 80 % микроорганизмов, изолированных из внешней среды, принадлежат типу А, и именно этот тип наиболее часто выделяется из пищевых продуктов. Как правило, это терморезистентные литические штаммы.
Количество клеток CI. perfringens, необходимых для инфекционной дозы человека, составляет 106/г. Оптимальная температура для роста — 43-47 °С, но микроорганизмы могут размножаться в диапазоне температур от 15 до 50 °С, время деления — 10-12 мин.
Замораживание или длительное охлаждение вызывает резкое уменьшение жизнеспособных (вегетативных) клеток. Споры различных штаммов CI. perfringens обладают различной устойчивостью к воздействию высоких температур, которая колеблется от 5 до 145 мин при 90 °С. Поэтому большая часть спор может выдержать температуры, используемые при кулинарной обработке; при тепловой активации споры начинают прорастать, формировать вегетативные клетки, которые размножаются при благоприятных условиях.
Микроорганизм растет в широких диапазонах рН (от 5 до 9); при значениях рН ниже 5 он погибает в течение 4-5 суток. Минимальное значение aw равно 0,95-0,96 (при значениях рН от 5,5 до 7,0).
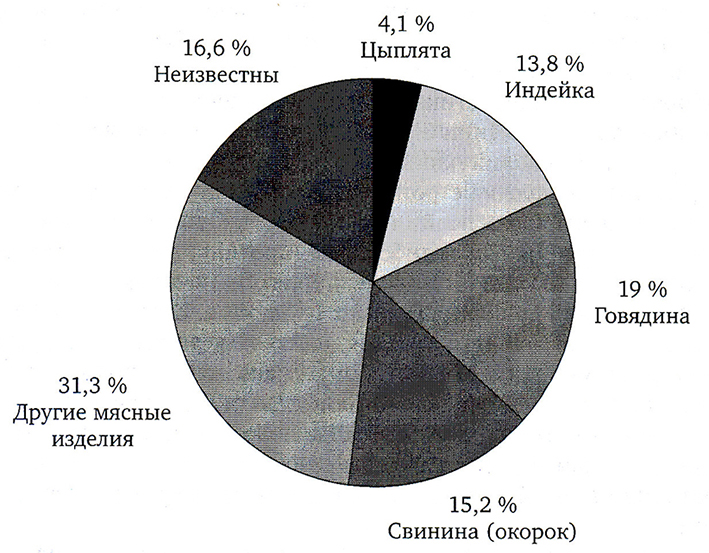
Рис. 4.2. Факторы передачи CI. perfringens инфекции в Великобритании [14]
Энтеротоксин, вызывающий отравление, представляет собой белок с молекулярным весом 36 ООО и изоэлектрической точкой 4,3. Токсин термолабильный и при прогреве при 60 °С его активность через 4 мин снижается в 10 раз. Выработка токсина происходит в процессе споруляции, и токсин высвобождается при выходе зрелых спор из спорангия. Спорообразование (неактивное) может иметь место в пищевых продуктах и редко — в кишечнике.
Имеются сходства между действием токсинов Cl. perfringens и холерного вибриона, которые вызывают в организме дисбаланс хлоридного и натриевого обмена. Однако полностью механизм патогенного действия Cl. perfringens А еще окончательно не выяснен. Скармливание инфицированной пищи обезьянам и волонтерам показало, что не все типы А-штаммов Cl. perfringens вызывают интоксикацию. Может быть, здесь действует не один тип энтеротоксина, а их комбинации.
Высока численность людей, выделяющих энтеротоксигенные Cl. perfringens А в фекалиях и имеющих антиэнтеротоксинные антитела в крови, но остающихся чувствительными к энтеротоксину.
Хотя Cl. perfringens является нормальным обитателем толстого кишечника, отравление наступает из-за споруляции организма в тонком кишечнике, после его «поглощения» с пищей. Человек является не менее важным носителем Cl. perfringens, чем крупный рогатый скот или птицы.
Другие типы Cl. perfringens (В, С, D, Е), которые вызывают энтеротоксемию у животных, быстро размножаются у них в кишечнике и производят токсины. Хотя животные не являются прямым источником инфекции, их продукты (мясо и птица) довольно часто контаминированы Cl. perfringens типа А. Сами микроорганизмы убиквитарны и почти всегда выделяются из почвы и пыли.
Лабораторная диагностика для подтверждения пищевого отравления основана на выделении Cl. perfringens (того же серовара) из пищевых продуктов и фекалий пациента.
Профилактика должна строиться на соблюдении общих принципов пищевой гигиены вдоль всей пищевой цепи. Однако, учитывая убиквитарность Cl. perfringens, наибольший превентивный эффект может быть достигнут в ее конечном звене, путем обеспечения правил личной гигиены и условий хранения готовых продуктов. Слишком длительное их выдерживание при температуре, близкой к оптимальной для размножения вегетативных клеток Cl. perfringens, или слишком медленное охлаждение продуктов, являются наиболее распространенными причинами, которые могут привести к пищевому отравлению. Поэтому быстрое охлаждение и хранение пищевых продуктов на холоде, что подавляет рост Cl. perfringens, являются надежными профилактическими мерами.
CLOSTRIDIUM BOTULINUM
Ботулизм — тяжелое нервно-паралитическое заболевание, а его возбудитель — Cl. botulinum широко распространен во внешней среде. Хотя этот анаэробный микроорганизм и классифицируется как единый вид, он состоит, по крайней мере, из трех генетически различающихся групп, обладающих способностью производить нейротоксины с аналогичными фармакологическими свойствами, но имеющих различные серологические характеристики (семь типов токсинов от А до G). Ботулизм человека вызывается штаммами Cl. botulinum, которые продуцируют токсины типа А, В и Е. С развитием заболевания людей также ассоциируются нейротоксигенные штаммы Cl. baratii (которые продуцируют токсин типа F) и Cl. butyricum (токсин типа Е).
Известны различные формы ботулизма: пищевой этиологии, раневой ботулизм, ботулизм новорожденных (кишечная колонизация у грудных детей).
Симптомы пищевого ботулизма вследствие потребления токсина, накопленного в пищевом продукте, развиваются довольно быстро — в течение 12-24 ч (от желудочно-кишечных до нервно-паралитических) и могут закончиться параличом дыхательной мускулатуры. Однако с внедрением поддерживающей терапии с помощью искусственной вентиляции легких удалось значительно снизить уровень смертельных исходов (до 5-10 % заболевших). Единственное специфическое медикаментозное лечение — применение антитоксина.
Европейская программа ВОЗ по эпидемиологическому надзору за пищевыми инфекциями и интоксикациями в своем первом отчете в 1981 г. указала на случаи ботулизма в Греции, Финляндии, Швеции, а также о выделении Cl. botulinum типа Е в Швейцарии из консервов, произведенных в Гонконге. В дальнейшем страны — участницы программы ВОЗ информировали о случаях пищевого ботулизма в ФРГ, Испании, Франции, США. В частности, в ФРГ за период 1962-1981 гг. зафиксировано 1897 случаев этой интоксикации, из них 63 закончились смертельным исходом.
Во Франции с 1993-1996 гг. все вспышки ботулизма были вызваны типом В. В ФРГ и Франции в 1997-1998 гг. были отмечены случаи ботулизма (тип Е), связанные с употреблением морских продуктов. Особую озабоченность в этом отношении вызывает ботулизм типа Е, связанный с потреблением морепродуктов Балтийского моря. Анализ, проведенный финскими специалистами, выявил с помощью полимеразной цепной реакции контаминацию Cl. botulinum тип Е от 3 до 10 % морепродуктов этого моря.
Факторами передачи инфекции наиболее часто являются домашние консервы. Отмечены случаи ботулизма вследствие потребления коммерчески произведенных консервов и других продуктов питания (маринованные грибы, сыр, копченая рыба и др.) (рис. 4.3). В США выявлены новые факторы передачи ботулизма: запеченный в фольге картофель, приправа на основе сыра, жареный лук под слоем сливочного масла, чеснок в растительном масле, а также традиционно приготовленная соленая рыба.
В 1972 г. в Калифорнии (США) впервые был описан ботулизм грудных детей, который рассматривается как самостоятельная форма заболевания, поражающая детей в возрасте до 6 месяцев. При этой форме заболевания интоксикация наступает не вследствие потребления продуктов, содержащих токсины Cl. botulinum, а в результате попадания в кишечник грудных детей пищи со спорами данного микроорганизма. Последние находят в нем оптимальные условия, в частности из-за отсутствия защитной кишечной флоры, активно прорастают и образуют токсин. В настоящее время данное заболевание зарегистрировано в большинстве штатов США, Канаде, Аргентине, Англии, Австралии.
В Европе это заболевание встречается относительно редко. Так, за период 1997-1998 гг. было зарегистрировано семь случаев ботулизма грудных детей. Данная форма интоксикации обычно вызывается токсинами типа А, В и редко — F. Признаки и симптомы включают: запор с последующим возникновением нервно-мышечного паралича, поражающего черепные нервы и нервы и распространяющегося на периферическую и дыхательную мускулатуру.
Эпидемиологическое расследование случаев ботулизма грудных детей (в США, ФРГ, Италии, Испании) показало, что большинство из них связаны с потреблением меда, в котором обнаружены споры Cl. botulinum. Как известно они встречаются повсеместно (в почве, в трупах животных, рыбы и насекомых, загрязняя воду, растения и т. д.) и могут легко попасть как на поверхность тела пчелы, так и в ее организм.
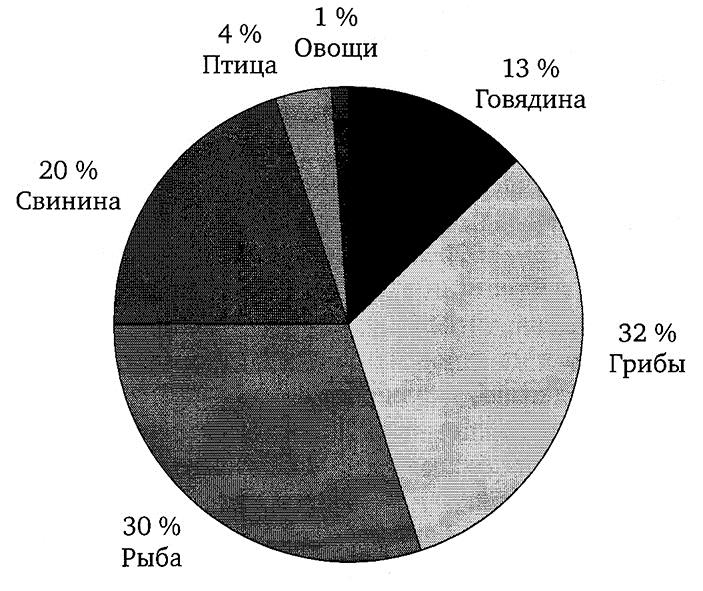
Рис. 4.3. Продукты, послужившие причиной ботулизма в России [13]
В эксперименте показано, что споры Cl. botulinum, введенные в организм пчел с подкормкой, быстро выводятся и обнаруживаются в том же количестве в меде. Споры не могут прорастать в нем и производить токсин, однако мед рассматривается как потенциально опасный продукт для грудных детей. Американская академия детских врачей советует родителям, чтобы уменьшить возможный риск заболевания ботулизмом, не давать его детям до 9 месяцев. Этому совету последовала одна из крупнейших компаний по производству меда в США, которая снабдила свою продукцию этикеткой, предупреждающей потребителя о том, что мед не следует давать в пищу детям до 1 года.
Предотвращение отравления во многом зависит от знания факторов, влияющих на жизнедеятельность Cl. botulinum, которые хорошо изучены. В частности, организм (типы А и В) размножается в диапазоне температур от 10 до 50 °С. Тип Е может размножаться и производить токсин при 3,3 °С (требуется от 31 до 45 суток), верхний температурный предел его роста — около 45 °С.
Высокая температура может быть эффективно использована для инактивации спор. Так, показатель D90 для спор микроорганизма типов А и В (время, необходимое для уничтожения 90 % популяции спор) составляет при температуре 121,1 °С от 6 до 12 с. Значение D90 для спор типа Е (при температуре 80 °С) составляет от 30 с до 3,3 мин. Споры Cl. botulinum высоко устойчивы к замораживанию, но вегетативные клетки почти так же чувствительны к холодовому воздействию, как и клетки грамотрицательных бактерий.
Доза облучения, инактивирующая споры, колеблется от 3,5 до 5,28 Мрад (в зависимости от типа организма, окружающей температуры, присутствия солей в субстрате, водной активности обрабатываемой среды).
Образование спор и синтез токсина происходит при значениях aw ~ 0,95 (тип А), 0,94 (тип В), 0,97 (тип Е) при прочих оптимальных условиях.
Организм при благоприятных температурах может расти и образовывать токсины в мясных продуктах, в которых не содержится нитрит. Последний обычно используют при производстве мясных продуктов, хотя отношение к нему несколько настороженное, что вызвано случаями появления в вареном беконе нитрозамина (канцерогенного вещества), а также подозрением, что нитрит сам может быть канцерогеном.
Clostridium botulinum типов А и В не размножается в пищевых продуктах при рН 4,6 или ниже. Устойчивость микроорганизма в кислой среде уменьшается, если в ней имеется хлористый натрий. Тип Е наиболее чувствителен к кислотам (минимальное значение рН, необходимое для его развития, составляет 5,0).
Токсин полностью инактивируется в пищевом продукте при нагреве до 80 °С в течение 30 мин и в течение соответственно меньшего времени при 100 °С. Профилактика ботулизма в глобальном масштабе осуществляется Всемирной организацией здравоохранения, которая координирует систему но «экстренному предупреждению» (early warning system) стран в отношении наиболее опасных пищевых инфекций и интоксикаций.
Основная задача этой системы — предотвратить в странах возможные вспышки тяжелых пищевых отравлений, включая ботулизм. Так, в начале 1982 г. в Бельгии было зарегистрировано два случая ботулизма (тип Е), вызванных потреблением консервов лосося, произведенных на Аляске (США). Через каналы «раннего оповещения» ВОЗ удалось не только предупредить о возможной опасности все регионы мира, но и приостановить производство и изъять инкриминированные консервы из международной торговли. В 1999 г. был изъят из международной торговли контаминированный Cl. Botulinum итальянский овощной суп, который продавался в ряде европейских стран.
С ростом промышленного производства продуктов питания и интенсификации международной торговли пищевыми продуктами такие случаи могут встречаться все чаще.
CLOSTRIDIUM DIFFICILE
Cl. difficile — крупные (от 0,5-1,9 до 3,0-16,9 мкм) подвижные грамположительные спорообразующие палочки, являющиеся облигатными анаэробами (род Clostridium). Споры устойчивы к нагреванию и способны к длительному (до нескольких лет) существованию в аэробных условиях. Оптимальная температура роста вегетативных форм — 30-37 °С. Cl. difficile повсеместно распространены в окружающей среде и выделяются из толстого отдела кишечника многих видов животных, а в некоторых случаях обнаруживаются и в испражнениях здоровых людей разных половозрастных групп. Эндоспоры могут выделяться в больших количествах не только пациентами с симптомами, но и бессимптомными носителями, особенно молодыми. По различным данным, от 3 до 6 % здоровых людей являются носителями Cl. difficile. У новорожденных и здоровых детей в возрасте до года Cl. difficile выделяются намного чаще — в 30-90 % случаев. Первоначально он был исключен как комменсал у здоровых детей, но был признан важной причиной антимикробной диареи в 1970-х гг. В настоящее время инфекция Cl. difficile (CDI) — это наиболее часто диагностируемая причина антимикробной и больничной диареи, а также причина практически всех случаев регистрируемого псевдомембранозного колита, причем иногда развивающееся заболевание приводит к смерти. Что касается инфекционной дозы Cl. difficile, то она точно не установлена, но считается низкой (100-1000 спор) и сильно зависит от различных факторов, связанных с хозяином.
Наиболее значимым фактором, определяющим восприимчивость к Cl. difficile, является микробном хозяина и функционирующая иммунная система. В этом отношении эффективный контроль может быть осуществлен путем снижения нагрузки Cl. difficile на окружающую среду наряду с усилением защиты хозяина от вирулентного кишечного патогена. При попадании в организм споры проходят через желудок, затем попадают в двенадцатиперстную кишку, где под действием желчных солей прорастают в вегетативные клетки. Клетки растут и размножаются в толстой кишке и слепой кишке, где вырабатываются энтеротоксины.
В настоящее время в большинстве стран все инфекции, вызываемые Cl. difficile (CDI), делят на две основные группы:
- HA-CDI (Hospital-associated Clostridium difficile infection) — инфекции, вызванные Difficile в результате лечения и (или) пребывания в на лечении в стационаре;
- CA-CDI (Community-associated Clostridium difficile infection) — инфекции, вызванные difficile, не связанные лечением и (или) пребыванием в на лечении в стационаре (или приобретенные в сообществе).
Исторически CDI считался в значительной степени нозокомиальным (HA-CDI), при этом экзогенные причины возникновения болезни в результате медикаментозного лечения считались основным источником колонизации и инфекции. Вместе с тем способность Cl. difficile вызывать заболевание, не связанное с проводимым лечением, и вне пребывания в лечебном учреждении (CA-CDI) была выявлена в 1982 г. Еще 20 лет назад это заболевание считалось довольно редким. Только тогда, когда удалось секвенировать весь геном Cl. difficile, было выявлено, что большинство случаев инфекции возникает вне лечебных стационаров. Что касается источника возбудителя, то он доподлинно не установлен, но одной из потенциально опасных причин является пища. Cl. difficile соответствует критериям пищевого патогена в отношении того, что он обычно встречается в разнообразных продуктах, включая мясо, морепродукты и свежие продукты. Однако ни одна вспышка болезней пищевого происхождения не была напрямую связана с Cl. difficile. Также нет убедительных доказательств того, что его споры могут размножаться и в пищевых продуктах. Это, однако, не исключает продуктов питания в качестве потенциального носителя, и, вполне вероятно, того, что это зоонозная пищевая инфекция. Хотя споры не развиваются в пищевых продуктах, достоверно установлено, что говядина, экстракт рыбы действительно поддерживают рост патогенных риботипов Cl. difficile при инокуляции вегетативными клетками.
ПАТОГЕННОСТЬ И ВУРУЛЕНТНОСТЪ
Основными факторами вирулентности являются токсин A (TcdA, энтеротоксин) и токсин В (TcdB, цитотоксин). Оба токсина могут разрушать эпителиальную поверхность слизистой оболочки и вызывать значительное воспаление толстой кишки. Третий крупный неродственный токсин обозначается бинарным токсином Cl. difficile (CDT). Бинарный токсин является еще одним фактором вирулентности, связанным с гипервирулентными штаммами, который усиливает активность токсинов А и В в механизме, нарушающем, как считается, иммунный ответ хозяина. Штаммы Cl. difficile, несущие бинарный токсин, но лишенные токсина А и В, также были обнаружены у пациентов с CDI. Это позволяет предположить, что последние два токсина не обязательно должны вызывать симптомы инфекции.
Достоверно известно, что большинство токсигенных штаммов продуцирует как TcdA, так и TcdB. Небольшой процент клинически значимых штаммов продуцирует TcdB, но не TcdA. Ранее распространенность бинарных токсинпродуцирующих штаммов была низкой (<10 %), однако в последние годы этот показатель возрос. В некоторых исследованиях количество выделенных штаммов, продуцирующих бинарные токсины, составляют более 30 % изолятов от человека. Другие факторы вирулентности, которые характерны для эпидемических или вспышечных штаммов, позволяют Cl. difficile прикрепляться к энтероцитам хозяина, прорастать в присутствии желчных солей, спорулировать при стрессе, проникать под кишечную слизь, образовывать биопленки, выживать и адаптироваться к защитным механизмам хозяина и неблагоприятным условиям окружающей среды.
ПАТОГЕННОСТЬ ПОДТИПОВ CL. DIFFICILE
Было разработано несколько методов для идентификации различных штаммов Cl. difficile с целью изучения его эпидемиологии. К ним относятся: мультилокусная типизация последовательностей (MLST), анализ тандемных повторов с мультилокусным переменным числом (MLVA), анализ рестрикционной эндонуклеазы (REA), гель-электрофорез в импульсном поле (PFGE), ПЦР-типирование с повторяющимися элементами, токсинотипирование и риботипирование.
ПЦР-риботипирование идентифицирует гены рибосомной РНК с использованием праймеров, комплементарных участкам 16-й и 23-й РНК. Было идентифицировано 116 различных риботипов Cl. difficile. Этот метод использовался для отслеживания CDI в Великобританиис 1995 г. ПЦР-обнаружение генотипов CDT (cdtA+ и cdtB+) позволяет идентифицировать бинарные токсины, продуцирующие штаммы Cl. difficile. К ним относятся UK PCR RT027, 078, 244, 126/127, 033 и 251 [37]. Напротив, PFGE анализирует весь геном с использованием специфических ферментов рестрикции, но является более дорогим и трудоемким. Токсинотипирование анализирует изменения в локусе патогенности (PaLoc), выявив 11 токсинотипов (0, I-X). Соответственно, штаммы часто классифицируются с использованием комбинации названий из разных методов набора.
В настоящее время наибольшее значение имеют два типа Cl. difficile:
- риботип 027, или NAP1 (североамериканский пульсовар 1) в соответствии с PFGE. Это штамм токсинотипа III, имеющий гены, кодирующие TcdA, TcdB и CDT. Данный штамм был вовлечен в вспышки тяжелых заболеваний на международном уровне, а также является распространенным эндемическим штаммом во многих регионах.
- риботип 078, токсинотип V, который соответствует NAP7 или NAP Подобно риботипу 027, этот штамм обладает генами, кодирующими TcdA, TcdB и CDT. Данный штамм продуцирует больше TcdA и TcdB in vitro, чем штаммы с tcdC дикого типа, но меньше, чем риботип 027. Вместе с тем имеются сообщения о заболеваниях, вызываемых и другими риботипами Cl. difficile.
УСТОЙЧИВОСТЬ ВО ВНЕШНЕЙ СРЕДЕ
Споры Cl. difficile обладают высокой устойчивостью к экстремальным физическим или биохимическим воздействиям. Они существуют на твердых поверхностях до 6 месяцев и даже дольше — на бетонных, деревянных или грязных поверхностях [45]. Замораживание (до -80 °С), нагревание (до 85 °С), сушка, ультрафиолетовое излучение, спиртовый гель и большинство дезинфицирующих средств оказались неэффективными при уничтожении. Спороцидным эффектом обладают пероксид водорода или дезинфицирующие средства на основе хлора. Моющие средства на основе четвертичных солей аммония и поверхностно-активных веществ не не обладают спороцидным действием и фактически способствуют споруляции вирулентных штаммов, таких как RT027 и RT001. Нагревание мяса до 63 и 71 °С (минимальные рекомендуемые температуры для приготовления морепродуктов и гамбургеров соответственно) устраняет всю вегетативную микробиоту, но увеличивает последующее прорастание спор Cl. difficile на 30 %.
ЭПИДЕМИОЛОГИЯ И ЭПИЗООТОЛОГИЯ
Носительство Cl. difficile у животных и наличие его в продуктах питания привлекло значительное внимание при исследовании возможности того факта, что CA-CDI имеют зоонозное происхождение.
Clostridium difficile часто встречается у разнообразных животных, включая домашних и сельскохозяйственных. Например, выделение Cl. difficile в различных странах от поросят составило 66-100 %, свиней — 31-91 %, телят — 17-94 %, кур — 5-29 %. При этом Cl. difficile выделялась от животных как с диареей, так и без нее. Некоторые исследования предполагают, что интенсивное животноводство увеличивает перенос токсигенного Cl. difficile, особенно при использовании антибиотиков у кормящих животных с маститом или у новорожденных телят и поросят. Выделенные изоляты при этом в большинстве случаев (75-90 %) относились к риботипу 078, хотя у отдельных животных (свиней, крупного рогатого скота и птицы) был обнаружен риботип 027. После проведенных изучений последовательности ДНК было установлено, что риботипы 078 у штаммов, выделенных у свиней, демонстрируют высокое сходство с таковыми, выделенными из клинических случаев человека, тем самым подтверждая передачу не только от животного к человеку, но также от человека к животному.
CLOSTRIDIUM DIFFICILE В ПИЩЕВЫХ ПРОДУКТАХ
Опасения относительно возможности передачи Cl. difficile через пищевые продукты неизбежно возникли после выделения Cl. difficile из фекалий животных (крупного рогатого скота, свиней и кур) в различных странах. Споры Cl. difficile были обнаружены в при проведении исследований в Северной Америке в розничных мясных продуктах, включая курицу (12,5 %), индейку (44,4 %), говяжий фарш (50 %), фарш из свинины (43 %) и свиную колбасу (63 %). В США это были преимущественно штаммы RT078 (75 %), но некоторые относились к штаммам RT027. Жизнеспособные споры были обнаружены как в готовом к употреблению, так и в сыром мясе, хотя абсолютное количество спор было низким и составило от 20 до 240 спор на грамм от говяжьего фарша и < 100 КОЕ/г в курином мясе. Инфицированность свинины составляла от 20 до 60 спор на грамм при прямом культивировании измельченной свинины — количество, достаточное для того, чтобы вызвать заболевание у восприимчивых хозяев.
Clostridium difficile был выделяют из продуктов, которые могут быть загрязнены фекалиями. Например, двустворчатые моллюски являются фильтраторами, которые потенциально могут накапливать кишечные патогенные микроорганизмы при выращивании в загрязненных водах. Из проведенных ограниченных исследований Cl. difficile был выделен как из моллюсков, так и из рыб, что указывает на потенциальный источник токсигенных штаммов. Инфицированность морепродуктов и моллюсков составила при этом 4-9 %.
Свежие продукты — еще одна группа пищевых продуктов, связанная со вспышками, вызванными кишечными патогенами. Инфицированность спорами Cl. difficile сырых овощей составило 2-3 %, обработанных овощей — 4-5 %, зелени —5-7 %, салата — 2-13 %. Опять же, выборочные исследования были ограничены и, в основном, были отобраны в розничной торговле, что вызывает вопросы относительно первоначального источника загрязнения. Тем не менее токсигенные, устойчивые к антибиотикам штаммы Cl. difficile были обнаружены в овощах, включая листовую зелень.
На основании проведенных исследований стало очевидно, что воздействие на организм человека низких концентраций Cl. difficile, вероятно, является очень распространенным явлением. Однако в связи с тем, что заболевание СА CDI встречается неравномерно, обязательной связи между приемом Cl. difficile и развитием заболевания, скорее, всего нет. Кроме того, рассмотрение СА CDI должно включать в себя не только исследования загрязнения мяса. Если учесть повсеместное распространение Cl difficile, то здоровые бактерионосители и окружающая среда могут быть не менее важным источником распространения болезни, чем пищевые продукты. Вполне возможно, что воздействие Cl. difficile является регулярным, если не ежедневным, событием и пища является лишь одним из многих возможных источников. Поэтому исследования СА CDI должны основываться на широком «экологическом» подходе, учитывающем все возможные источники воздействия (рис. 4.4).
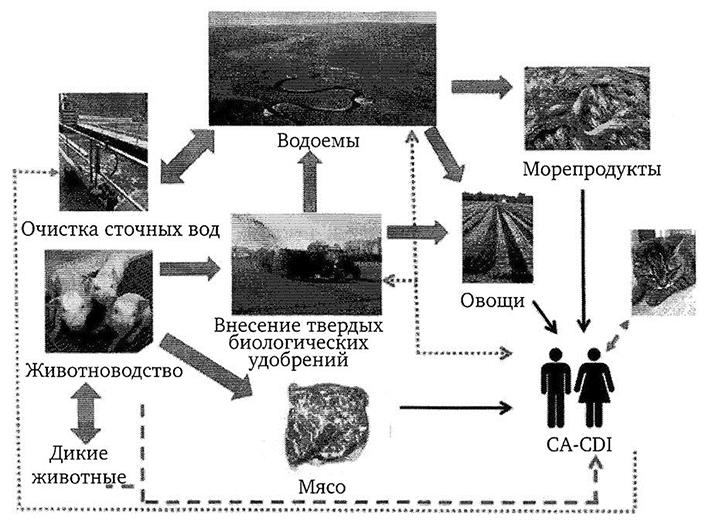
Рис. 4.4. Пути распространения Сl. difficile [57]
Вирус гепатита Е. Вирус гепатита Е (HEV) является важным, но не полностью изученным патогеном, вызывающим высокую смертность во время беременности и приводящим к хроническому гепатиту у людей с ослабленным иммунитетом. Основные механизмы, способствующие повреждению печени, остаются до конца не изученными. По данным ВОЗ, ежегодно происходит около 20 млн случаев инфекции HEV, что приводит к 3,3 млн случаев гепатита Е и более 44 ООО случаев смерти. В Российской Федерации с момента введения в регистрацию (2013) острого гепатита Е (HEV) показатель заболеваемости ежегодно составляет 0,7-0,8 на 100 тыс. населения. В 2016 г. ОГЕ зарегистрирован в 24 субъектах РФ: 69 % всех случаев выявлено в Центральном федеральном округе. Вирус HEV представляет собой небольшой РНК-вирус без оболочки, который передается главным образом фекально-оральным путем. Вирус вызывает заболевания людей в основном в развивающихся странах Азии и Африки, где санитарные условия плохие. Тем не менее отдельные случаи острого гепатита Е также были зарегистрированы у лиц, проживающих во многих промышленно развитых странах. Так, генотип 3 HEV преобладает в странах с высоким уровнем дохода, в том числе в Европе. Передача этого генотипа обычно является зоонозной и связана с потреблением продуктов из свинины, а в некоторых случаях — моллюсков. Инфекция, которая чаще всего протекает бессимптомно, может вызывать острый самоограничивающийся гепатит, причем симптоматическая инфекция чаще встречается среди мужчин старше 50 лет. Имеются сведения о хроническом протекании инфекции среди людей с ослабленным иммунитетом или с уже существующим заболеванием печени. Особенностью вируса гепатита Е является относительно высокая смертность (до 28 %) среди инфицированных беременных женщин.
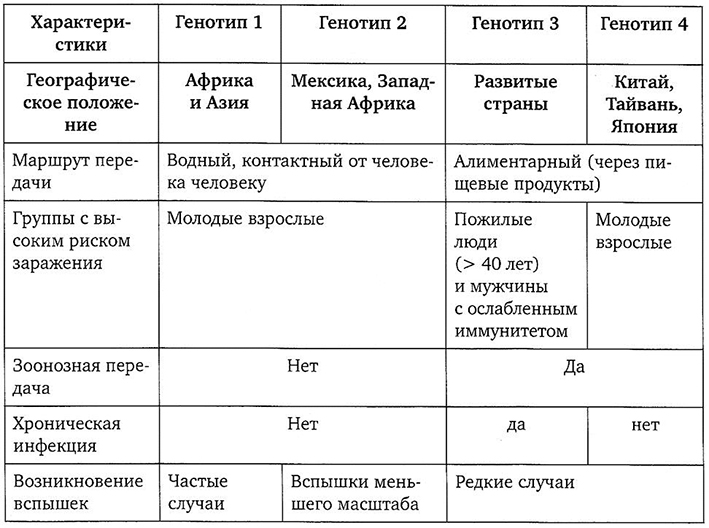
Уникальной характеристикой HEV является то, что он имеет различный клинический и эпидемиологический профиль в зависимости от того, где приобретена инфекция, что в основном обусловлено вирусным генотипом. Существует четыре генотипа HEV, вызывающих заболевание у людей, каждый из которых демонстрирует различные эпидемиологические и клинические характеристики между развивающимися и развитыми странами (табл. 4.3).
Таблица 4.3
Генотипы гепатита Е [61]
КЛАССИФИКАЦИЯ ВИРУСА
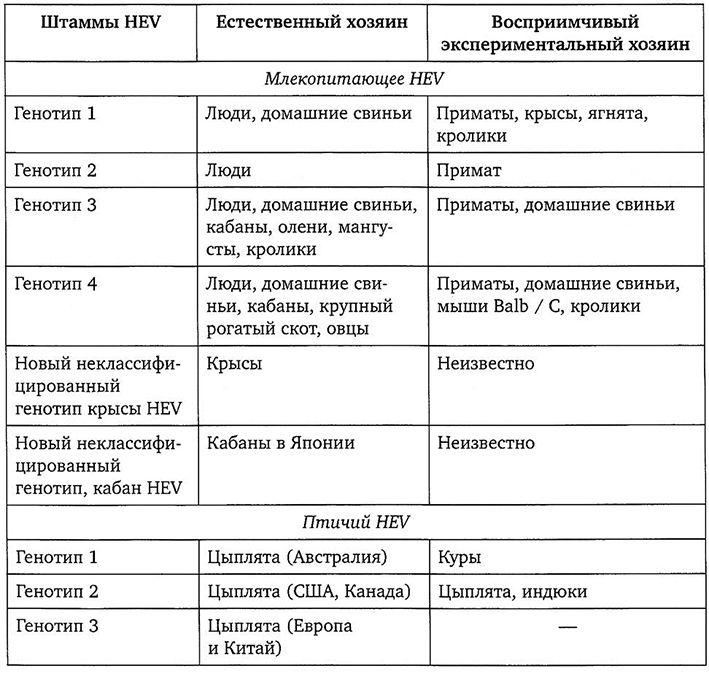
В настоящее время HEV классифицируется в семействе Hepeviridae. Вид единственного рода Hepevirus семейства включает в себя 4 признанных основных генотипа HEV млекопитающих: генотип 1 (бирманоподобные азиатские штаммы), генотип 2 (мексиканский штамм и некоторые африканские штаммы), генотип 3 (штаммы, вызывающие спорадические случаи гепатита человека во всем мире и штаммы от животных) и генотип 4 (штаммы, вызывающие спорадические случаи заболевания людей в Азии и штаммы от животных). Однако недавно были идентифицированы генетически отличные штаммы HEV от крыс и диких кабанов, таксономия HEV была пересмотрена (табл. 4.4). HEV крысы и новый штамм HEV дикого кабана из Японии, видимо, относятся к ранее неизвестным генотипам.
Таблица 4.4
Ареал хозяина и межвидовая инфекция вируса гепатита Е [64]
Гепатит Е в настоящее время является признанным зоонозом, а свиньи и, вероятно, некоторые другие виды животных являются резервуарами для HEV. Так, в ходе серологического исследования, проведенного в США, 295 ветеринаров, имевших контакты со свиньями из восьми штатов, а также 400 нормальных доноров крови, соответствующих возрасту и географии, были проверены на наличие IgG-анти-НЕ. Результаты показали, что приблизительно 23 % ветеринаров были серопозитивными в отношении IgG-анти-HEV (генотип вируса HEV свиньи 3) по сравнению с 17 % у нормальных доноров крови. При этом среди ветеринарных работников, которые использовали иглы при различных манипуляциях со свиньями, количество серопозитивных случаев было примерно в 1,9 раза выше, чем у тех, кто этого не делал. Кроме того, было установлено, что у рабочих свиноферм в Северной Каролине распространенность IgG против HEV в 4,5 раза выше, чем у лиц, не имевших контакта со свиньями. Таким образом, имеющиеся данные указывают на то, что люди, работающие в свиноводстве, подвергаются повышенному риску заражения зоонозной инфекцией HEV.
Другие виды животных, кроме свиней, также могут служить потенциальным резервуаром для HEV. Например, после проверки 87 полевых работников из Департамента природных ресурсов штата Айова и 332 нормальных доноров крови на распространенность антител к HEV было обнаружено, что рабочие департамента имели более высокую распространенность антител к HEV, чем нормальные доноры крови (Р < 0,05). Кроме того, сообщалось о возможных случаях передачи гепатита Е от домашних кошек и домашних свиней к их владельцам. Следовательно, прямой контакт с инфицированными животными является потенциальным фактором риска развития зоонозной инфекции HEV.
За последние 10-15 лет были достигнуты значительные успехи в понимании роли животных как резервуаров HEV. Выделение штаммов HEV от домашних свиней и диких кабанов, кур, кроликов, крыс, оленей, мангустов и, возможно, крупного рогатого скота и овец, а также существование других видов животных, которые серопозитивны в отношении антител к HEV, значительно расширили спектр хозяев и разнообразие HEV. Гепатит Е в настоящее время является признанным зоонозным заболеванием. Домашние свиньи, дикие кабаны и, вероятно, другие виды животных являются резервуарами для HEV. Повсеместное распространение вируса у домашних свиней и диких кабанов, а также у некоторых других видов животных вызывает озабоченность возможности передачи зоонозной инфекцией через прямые контакты с инфицированными животными или через потребление зараженного мяса животных. Так, было установлено, что примерно 2 % свиной печени продаваемой в продуктовых магазинах в Японии и 11 % — в США, содержат РНК HEV. При этом выделенный из продаваемой в продуктовых магазинах печени вирус остается полностью жизнеспособным и вызывает заболевание. Установлено также, что вирусы, выделенные из свиной печени, продаваемой в магазинах идентичны вирусам, выделенным от пациентов с гепатитом Е человека. В настоящее время чаще всего спорадические случаи острого гепатита Е связаны с потреблением загрязненной сырой и недоваренной свиной печени или жареной свинины. Помимо свинины угрозу инфицирования может представлять недостаточно термически обработанное мясо диких животных (кабаны, олени), а также морепродукты (моллюски, устрицы).
Контрольные вопросы и задания
- Дайте характеристику В. cereus и основные клинические признаки вызываемого заболевания. Назовите основные токсины.
- Охарактеризуйте эпидемиологию и биологию В. cereus. Какие продукты питания являются основными источниками.
- Назовите особенности экологии и поведения в пищевых продуктах В. cereus.
- Перечислите меры профилактики и контроля с В. cereus.
- Дайте характеристику Cl. perfringens и основные клинические признаки вызываемого заболевания. Назовите основные токсины.
- Охарактеризуйте эпидемиологию и биологию Cl. perfringens. Какие продукты питания являются основными источниками?
- Назовите особенности экологии и поведения в пищевых продуктах Cl. perfringens.
- Перечислите меры профилактики и контроля с Cl. perfringens.
- Дайте характеристику Cl. botulinum и основные клинические признаки вызываемого заболевания. Назовите основные токсины.
- Охарактеризуйте эпидемиологию и биологию Cl. botulinum. Какие продукты питания являются основными источниками? У каких групп населения регистрируются случаи кишечного ботулизма?
- Назовите особенности экологии и поведения в пищевых продуктах Cl. botulinum.
- Перечислите меры профилактики и контроля с Cl. botulinum.
- Дайте характеристику Cl. difficile и основные клинические признаки вызываемого заболевания. Назовите основные токсины.
- Охарактеризуйте эпидемиологию и биологию Cl. difficile. Какие продукты питания являются основными источниками. Чем различаются HA-CDI и CA-CDI инфекции, вызванные Cl. difficile?
- Назовите особенности экологии и поведения в пищевых продуктах Cl. difficile.
- Дайте характеристику вируса гепатита Е и основные клинические признаки вызываемого заболевания. Назовите генотипы, вызывающие заболевание.
- Охарактеризуйте эпидемиологию и биологию вируса гепатита Е. Какие продукты питания являются основными источниками? У каких групп населения наиболее высокая смертность от гепатита Е?

