Задачи микробиологического контроля на предприятиях пищевой отрасли: быстрое обнаружение микробных контаминантов и выявление путей их проникновения в производство; определение очагов и степени размножения микроорганизмов на отдельных этапах технологического процесса; предотвращение развития посторонней микрофлоры путем использования различных профилактических мероприятий; активное уничтожение микроорганизмов путем дезинфекции с целью получения высококачественной готовой продукции.
Микробиологический контроль должен проводиться заводскими лабораториями систематически. Он осуществляется на всех этапах технологического процесса, начиная с сырья и заканчивая готовым продуктом на основании государственных стандартов (ГОСТ), технических условий (ТУ), инструкций (ТИ), правил, методических указаний и другой нормативной документации, разработанной для каждой отрасли пищевой промышленности. Для отдельных пищевых производств имеются свои схемы микробиологического контроля, в которых определены объекты контроля, точки отбора проб, периодичность контроля, указывается, какой микробиологический показатель необходимо определить, приводятся нормы допустимой общей бактериальной обсемененности.
Микробиологический мониторинг на предприятии обычно включает следующие шаги.
- Выделение микроорганизмов из производственной среды.
- Посев (если требуется).
- Учет результатов.
- Анализ совокупности полученных при мониторинге данных.
Микробиологический контроль включает оценку микробной контаминации воды, воздуха производственных помещений, пищевых продуктов, санитарного состояния технологического оборудования, инвентаря, тары, гигиенического состояния обслуживающего персонала (рук, одежды и т. п.). Он осуществляется как микробиологической лабораторией предприятия, так и санитарно-эпидемиологическими станциями.
Возможное загрязнение внешней среды патогенными микробами определяют на основании косвенного показателя – обнаружения так называемых санитарно-показательных микроорганизмов: кишечной палочки, гемолитических стрептококков и стафилококков. Присутствие этих микроорганизмов в объектах внешней среды указывает на загрязненность их выделениями человека, животных, сточными водами биотехнологических производств и т. п.
В тех пищевых производствах, где применяются ферментные препараты, также обязателен микробиологический контроль их активности и биологической чистоты.
Санитарно-показательные микроорганизмы
Сведения о возможности опасного в эпидемическом отношении загрязнения окружающей среды дает количественный учет санитарно-показательных микроорганизмов. Это связано с тем, что непосредственное обнаружение патогенных микроорганизмов в естественных субстратах (почве, воде, воздухе) наталкивается на следующие трудности:
- патогенные микроорганизмы встречаются в объектах окружающей среды не постоянно, а главным образом в период эпидемических вспышек;
- количество патогенных микроорганизмов во внешней среде значительно уступает количеству непатогенных;
- применение элективных сред и методов культивирования патогенных микроорганизмов не всегда гарантирует успех.
Поэтому возможное загрязнение внешней среды патогенными микроорганизмами определяют на основании косвенного показателя – обнаружения так называемых индикаторных микроорганизмов. Присутствие санитарно-показательных микроорганизмов в объектах внешней среды указывает на загрязненность их выделениями человеческого организма, а следовательно, и возможность наличия в них соответствующих патогенных микроорганизмов. Чем больше количество санитарно-показательных микроорганизмов в исследуемом объекте, тем больше он загрязнен выделениями человеческого организма и тем вероятнее, что в нем содержатся патогенные микроорганизмы – возбудители инфекционных заболеваний.
Индикаторная ценность микроорганизма определяется по ряду критериев:
- индикаторный микроорганизм должен иметь общее место естественного обитания с соответствующим патогенным микроорганизмом и аналогичный способ распространения в окружающей среде;
- санитарно-показателъные микроорганизмы должны несколько превосходить патогенные микроорганизмы по выживаемости в окружающей среде, по устойчивости к воздействию различных физических, химических и биологических факторов;
- одними из условий при выборе санитарно-показательного микроорганизма являются простота, доступность методов его определения, быстрота в получении ответа.
Многолетние исследования, подтвержденные практикой во многих странах мира, позволили отдать предпочтение бактериям группы кишечной палочки (БГКП) (рис. 16) как основному и наиболее надежному показателю фекального загрязнения воды, пищевых продуктов, смывов с оборудования и рук персонала.
Рис. 16. Кишечная палочка Escherichia coli (фото, х 1250)
Гемолитические стафилококки являются санитарно-показательными микроорганизмами загрязнения воздуха, т. к. они являются постоянными обитателями слизистых оболочек рта и верхних дыхательных путей человека. В группу санитарно-показательных спорообразующих анаэробов почвы входят грамположительные споровые палочки – Clostridium perfringens и Clostridium sporogenes.
Контроль пищевых продуктов
Для оценки качества сырья, полуфабрикатов, вспомогательных материалов, готовой продукции в нашей стране обязательно используются два показателя – общая микробная обсемененность (общее микробное число – ОМЧ) или количество мезофильных аэробных и факультативно анаэробных микроорганизмов (КМАФАнМ) и бактерии группы кишечной палочки (БГКП). На практике ОМЧ и КМАФАнМ оцениваются числом жизнеспособных клеток, способных образовывать колонии на поверхности питательной среды, и выражаются количеством колониеобразующих единиц (КОЕ).
Показатели общей бактериальной обсемененности, ОМЧ, КМАФАнМ выражают в КОЕ/г или КОЕ/см3 и определяют в основном путем высева продукта или пробы на стандартную плотную питательную среду методом глубинного посева. После посева чашки инкубируют (78 ± 3) ч при температуре (30 ± 1) °С. По окончании срока производят подсчет выросших колоний. Число колоний, выросших на каждой чашке Петри, пересчитывают на 1 г или 1 см3 продукта.
Необходимо заметить, что полученные результаты будут меньше истинной контаминации продукта, так как микроорганизмы обладают способностью адсорбироваться на взвешенных веществах с образованием трудноразделимых в процессе взбалтывания комплексов, которые при посевах могут регистрироваться как один микроорганизм. Чашечным методом учитываются только сапрофитные мезофильные бактерии (аэробы и факультативные анаэробы). Термофильные и психрофильные бактерии не растут из-за несоответствия температуры оптимальной; анаэробы не растут, поскольку выращивание проводится в аэробных условиях; другие бактерии (в частности, патогенные) не растут из-за несоответствия компонентного состава питательной среды и условий культивирования. Не образуют колоний мертвые клетки. Однако эти микроорганизмы можно не учитывать и ошибкой анализа пренебречь, поскольку сапрофиты являются основными возбудителями порчи пищевых продуктов. Для этого в микробиологических исследованиях введено понятие доверительного интервала.
В некоторых производствах используются дополнительные микробиологические показатели, например, количество анаэробных, термофильных, спорообразующих и других микроорганизмов, характерных для каждого вида исследуемого объекта. Для их учета имеются специальные методические приемы, описанные в соответствующей нормативной документации. Например, для определения процентного содержания спорообразующих бактерий посев производят из пробирок с разведениями проб, предварительно прогретых несколько минут на кипящей водяной бане. При высевах из прогретых проб вырастают только спорообразующие бактерии, а из непрогретых – все остальные. Затем рассчитывают процентное содержание спорообразующих форм микроорганизмов.
Чем выше показатель общей бактериальной обсемененности, тем больше вероятность попадания в исследуемый объект патогенных микроорганизмов – возбудителей инфекционных болезней и пищевых отравлений. Обычно в 1 г (или 1 см3) продукта, не прошедшего термической обработки, содержится не более 100 тысяч сапрофитных мезофильных бактерий.
Определение БГКП (колиформных бактерий) основано на способности колиформных бактерий расти на дифференциально-диагностических средах, сбраживая лактозу с образованием кислоты и газа.
Санитарно-микробиологическое исследование воды
Вода является благоприятной средой для развития различных микроорганизмов, в том числе и возбудителей многих инфекционных заболеваний. В связи с этим санитарно-микробиологический анализ водоемов и питьевой воды является обязательным и важнейшим этапом системы контроля качества воды. Качество питьевой воды, подаваемой централизованными водопроводами для питьевых и хозяйственно-бытовых целей, должно соответствовать гигиеническим нормам (см. СанПиН 2.1.4.1074-01).
Сведения о возможности опасного загрязнения окружающей среды дает количественный учет санитарно-показательных микроорганизмов. Обнаружение данных микроорганизмов в воде следует рассматривать как показатель фекального загрязнения, а их количество позволяет судить о степени этого загрязнения, а значит, о возможности присутствия патогенной микрофлоры.
Преимущество БГКП как показателя фекального загрязнения состоит в полном соответствии основным требованиям, предъявляемым к санитарно-показательным микроорганизмам.
К БГКП относятся грамотрицательные, не образующие спор палочки, ферментирующие лактозу, глюкозу, маннит, мальтозу при 37 °С в течение 24 ч и не обладающие оксидазной активностью. Таким образом, кишечная палочка, представитель нормальной микрофлоры кишечника человека, является показателем фекального загрязнения объектов внешней среды.
Чаще всего при санитарно-микробиологическом исследовании воды на производствах проводят следующие определения:
- микробного числа – общее количество микроорганизмов в 1 см3 воды;
- микробного числа – общее количество микроорганизмов в 100 см3 воды при 37ºС;
- микробного числа – общее количество микроорганизмов в 100 см3 воды при 22ºС;
- количества общих и термотолерантных колиформных бактерий в 100 см3;
- спор сульфитредуцирующих клостридий.
Безопасность питьевой воды в эпидемическом отношении определяется ее соответствием нормативам по микробиологическим и паразитологическим показателям, представленным в табл. 4.
Таблица 4
Микробиологические и паразитологические показатели безопасности питьевой воды
| Показатели | Единицы измерения | Нормативы |
| Термотолерантные колиформные бактерии | Число бактерий в 100 см3 | Отсутствие |
| Общие колиформные бактерии | Число бактерий в 100 см3 | Отсутствие |
| Общее микробное число | Число образующих колонии бактерий в 1 см3 | Не более 50 |
| Колифаги | Число бляшкообразующих единиц (БОЕ) в 100 см3 | Отсутствие |
| Споры сульфитредуцирующих клостридий | Число спор в 20 см3 | Отсутствие |
| Цисты лямблий | Число цист в 50 дм3 | Отсутствие |
Внутренний контроль качества санитарно-микробиологических исследований воды проводят в соответствии с МУ 2.1.4.1057-01.
Отбор проб производят в соответствии с МУК 4.2.1018-01. Воду для санитарно-микробиологического исследования отбирают в стерильные емкости.
Из кранов водопроводных сетей отбор проб воды производят после предварительного фламбирования кранов и спуска воды в течение 10 мин при полном открытии крана.
Определение общего микробного числа воды. Общее микробное загрязнение определяется количеством микроорганизмов, содержащихся в 1 см3 воды, глубинным посевом на питательный агар. В водопроводной (или питьевой) воде в соответствии с СанПиН 2.1.4.1074-01 микробное число не должно превышать 50 КОЕ в 1 см3. В соответствии с требованиями ВОЗ (Всемирной организации здравоохранения) ОМЧ также определяют, инкубируя посевы при 37 и 22ºС.
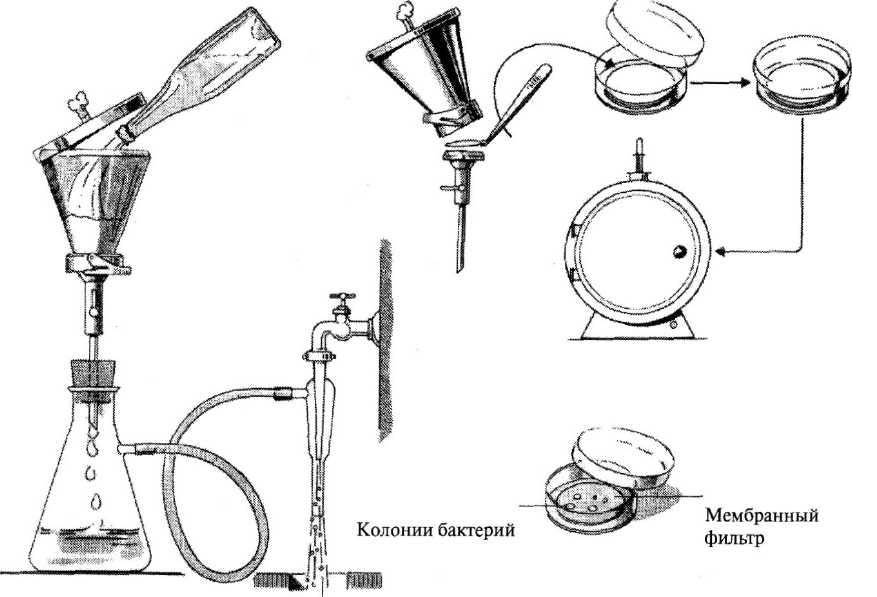
Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод). Общие колиформные бактерии (ОКБ) – грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре (37 ± 1) °С в течение 24-48 ч.
Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре (44 ± 0,5) °С за 24 ч.
Определение ОКБ и ТКБ методом мембранной фильтрации предполагает фильтрацию установленного объема воды через мембранные фильтры, выращивание посевов на дифференциальной питательной среде с лактозой и последующей идентификацией колоний по культуральным и биохимическим свойствам.
При исследовании питьевой воды анализируют 3 объема по 100 см3. При получении стабильных отрицательных результатов допустима фильтрация 300 см3 воды через один фильтр.
При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 см3 воды).
Отмеренный объем воды фильтруют через мембранные фильтры. По окончании фильтрации фильтр аккуратно снимают стерильным пинцетом и помещают в центр чашки Петри на поверхность среды Эндо фильтрующей поверхностью вверх. При этом следует избегать образования пузырьков воздуха между средой и фильтром. Чашки с фильтрами ставят в термостат и инкубируют посевы при температуре (37 ± 1) °С в течение (24 ± 2) ч (рис. 17). Если на фильтрах нет роста или выросли колонии пленчатые, губчатые, плесневые, прозрачные, расплывчатые, выдают отрицательный ответ: отсутствие ОКБ и ТКБ в 100 см3 исследуемой воды.
Рис. 17. Схема определения общих и термотолерантных колиформных бактерий методом мембранной фильтрации
Санитарно-микробиологическое исследование воздуха
Микробиота воздуха весьма немногочисленна и не отличается разнообразием. Ее количественный и качественный состав зависит от места, над которым исследуется воздух. Воздух является неблагоприятной средой для развития и жизнедеятельности микроорганизмов, т. к. в нем нет питательных веществ и пагубно влияет УФ-излучение.
Задачей микробиологического контроля является получение репрезентативной оценки микробной нагрузки производственной среды.
Текущий контроль бактериальной загрязненности воздуха в принципе не может и не должен выявить или подсчитать все микроорганизмы, присутствующие в контролируемой среде. Он может только показать, что все ключевые системы, контролирующие состояние производственной среды, работают в соответствии с установленными требованиями и лимиты бактериальной нагрузки не превышены. В пробе воздушных масс учитывают общее число микроорганизмов, содержащихся в определенном объеме воздуха, и качественный состав микрофлоры воздуха.
В воздухе закрытых помещений содержится большое количество различных форм микроорганизмов: пигментированные бактерии, микрококки, спорообразующие палочки, дрожжи, мицелиальные грибы. Санитарно-показательными микроорганизмами воздуха являются гемолитические стафилококки, т. к. эти микроорганизмы – постоянные обитатели слизистых оболочек полости рта, верхних дыхательных путей человека.
Для оценки санитарно-гигиенического состояния воздуха помещений определяют общее количество микробов, находящихся в 1 м3 воздуха и количество санитарно-показательных микроорганизмов в том же объеме воздуха.
Санитарно-микробиологическое исследование воздуха проводится несколькими методами: седиментационным, аспирационным, барботированием стерильной воды или физиологического раствора с последующим высевом пробы на питательную среду методом мембранной фильтрации или пропусканием воздуха непосредственно через питательную среду.
Седиментационный метод (метод Коха) – оседание микроорганизмов под воздействием силы тяжести на поверхность питательной среды чашки Петри. Количество выросших колоний соответствует степени загрязненности воздуха: по приблизительным подсчетам на площадь 100 см2 (площадь чашки Петри) в течение 5 мин попадает столько микробов, сколько их содержится в 10 дм3 воздуха. Описанный метод относится к пассивным (качественным), он позволяет лишь определить спектр присутствующих микроорганизмов. Главным его недостатком является выявление только больших быстрооседающих частиц в объеме отобранной пробы.
Аспирационный метод связан с применением аппарата, который дает возможность исследовать определенный объем воздуха. Работа его основана на принципе ударного действия струи воздуха. Аппарат состоит из узла для отбора проб воздуха, микроманометра и электромотора. Засасываемый воздух распределяется по поверхности среды чашки Петри, помещенной во вращающемся устройстве. Скорость просасывания воздуха должна быть около 25 дм3/мин. Экспозиция в течение 4–5 мин (т. е. пропускание 100 дм3 воздуха) позволяет выявить общее количество микроорганизмов. Затем чашки Петри закрывают, инкубируют в течение 24 ч в термостате при 37°С и 24 ч при комнатной температуре и подсчитывают число выросших колоний.
Бактериальную загрязненность воздуха оценивают по количеству микроорганизмов в 1 м3 воздуха, используя готовые производственные таблицы, или рассчитывают по формуле Омелянского:
Х=(А • 100 • 1000 • 5)/(В • 10 • Т),
где X – количество микроорганизмов в 1 м3 воздуха; А – количество колоний в чашке; В – площадь чашки, см2; Т – время, в течение которого чашка была открыта, мин; 5 – время по расчету Омелянского, мин; 10 – объем воздуха, из которого происходит оседание микробов за 5 мин, дм3; 100 – площадь, на которую происходит оседание, см2; 1000 – искомый объем воздуха, дм3.
В. Л. Омелянский установил, что за 5 мин при спокойном состоянии воздуха на площадь 100 см2 оседает столько микроорганизмов, сколько их содержится в 10 дм3 (это описано выше как метод Коха).
Для выявления санитарно-показательной микрофлоры ранее использовали кровяной агар, на котором данные микроорганизмы растут желтыми с ровными краями колониями и вызывают гемолиз клеток крови, в результате чего среда вокруг колонии становится прозрачной, или проводили посев на чашки Петри с желточно-солевым агаром (элективность среды обусловливается содержанием высокой концентрации хлорида натрия). При этом большая часть патогенных стафилококков, образующих летициназу, дает реакцию, проявляющуюся в образовании вокруг колонии зоны просветления с радужным венчиком по периферии.
В настоящее время для определения количества Staphylococcus aureus применяют агар Байрд-Паркера, а образование термостабильной нуклеазы устанавливают при необходимости определения его потенциальной энтеротоксигенности.
Микробная обсемененность различных помещений неодинакова. Критерии чистоты воздуха жилых помещений приведены в табл. 5.
К воздуху производственных цехов пищевых производств предъявляются более строгие требования.
Таблица. 5
Критерий для оценки воздуха жилых помещений
(число микроорганизмов в 1 м3 воздуха по А. И. Шарифу)
| Режим | Воздух | |
| чистый | загрязненный | |
|
Летний: всего микробов условно-патогенные |
1500 16 |
2500 36 |
|
Зимний: всего микробов условно-патогенные |
4500 36 |
7000 124 |
Воздух производственных цехов пищевых производств считается чистым, если в нем содержится не более 500 сапрофитных микроорганизмов в 1 м3. Вторым показателем является количество в том же объеме воздуха санитарно-показательных микроорганизмов – гемолитических стафилококков. Обнаружение их в воздухе производственных помещений указывает на санитарное неблагополучие данного объекта и возможность возникновения у персонала инфекционных заболеваний, вызываемых микрофлорой дыхательных путей, которая передается через воздух (ангины, гриппа, коклюша, дифтерии, туберкулеза и др.). Такой воздух может стать источником обсеменения пищевых продуктов, а следовательно, представлять потенциальную опасность для здоровья людей.
Определение в воздухе санитарно-показательных микроорганизмов проводят только по эпидемиологическим показаниям городские центры эпидемиологии и гигиены.
Санитарно-микробиологическое исследование смывов с рук, инструментов и предметов производства
Причиной присутствия посторонних микроорганизмов могут быть недостаточная чистота на производстве и несоблюдение людьми правил личной гигиены. С одеждой и обувью работающего персонала в цеха часто заносятся зерновая пыль, грязь, посторонние микроорганизмы. Этот источник трудно контролировать. Здесь главным в борьбе с микроорганизмами – контаминантами производства является строгое соблюдение чистоты и личной гигиены рабочими.
Правилами личной гигиены предусмотрен ряд требований к содержанию тела, рук, полости рта, спецодежды, медицинскому освидетельствованию.
На поверхности кожи здорового человека находится большое число микроскопических грибов, бактерий – стафилококков, стрептококков. При травмах патогенные микроорганизмы проникают в глубокие слои кожи и вызывают гнойничковые заболевания. Особую опасность они представляют на руках и открытых частях тела в связи с угрозой попадания в пищевые продукты стафилококков, стрептококков. На различных участках тела встречаются разные группы микроорганизмов, например:
- на коже – Corynebacterium, Staphylococcus, Bacillus;
- в носу – Micrococcus, Corynebacterium, Staphylococcus;
- .в подмышечных впадинах – Micrococcus, Corynebacterium, Sarcina;
- во рту (на деснах) – Corynebacterium, Streptococcus.
Для предотвращения контаминации посторонними микроорганизмами сырья и полуфабрикатов в процессе их переработки и готовой продукции при хранении необходимым условием также являются поддержание чистоты на рабочем месте, в производственных помещениях, санитарная обработка оборудования, полов, инвентаря, дренажей, тары.
Изучение бактериальной загрязненности рук и предметов окружающей обстановки, инструментов, оборудования производят в целях:
- оценки бактериальной контаминации производственного помещения, поверхностей и воздушных масс;
- установления путей распространения инфекции при эпидемиологических обследованиях;
- контроля эффективности обработки рук и одежды персонала;
- проверки эффективности мойки и дезинфекции оборудования.
В зависимости от цели проводимого исследования и характера контролируемых объектов в полученных смывах определяют:
- общую микробную обсемененность – ее оценивают посевом в питательный агар (СПА; Стандарт-1-Агар, Plaunt Count Agar и др.). При необходимости определяют количество микробов в 10, 100 см3 смыва и с площади исследуемой поверхности 24– 30 см2, возможно при необходимости снятие отпечатков пальцев на агаре;
- наличие термотолерантных колиформных бактерий как показателей фекального загрязнения, свидетельствующих о грубых нарушениях санитарного режима. Для обнаружения бактерий группы кишечной палочки делают посев на селективные питательные среды (Endo, MacConkey, но допускают и другие сходные с ними среды). В смывах с рук персонала цехов не должны присутствовать бактерии группы кишечной палочки.
Бактериальную контаминацию рук и одежды определяют путем исследования микрофлоры смывов. В смывах, которые берут перед началом работы, обычно определяют общую бактериальную обсемененность и наличие бактерий группы кишечной палочки. Наличие бактерий группы кишечной палочки в смывах с рук и одежды не допускается.
Чистоту рук оценивают по количеству микроорганизмов в 1 см3 смыва:
- отлично – до 1000;
- хорошо –1000-5000;
- удовлетворительно – 5000–10 000;
- плохо – свыше 10 000.
При контроле мелких предметов смывы проводят с поверхности всего предмета. При контроле предметов с большой поверхностью смывы проводят с площади не менее 100 см2. Смывы с поверхности предметов делают с помощью трафаретов из проволоки, имеющих площадь 25, 50 или 100 см2. Трафареты перед взятием смыва стерилизуют путем прокаливания в пламени горелки, затем быстро охлаждают и накладывают на поверхность стола и т. д., и с площади, ограниченной трафаретом, производят смыв. Затем ватный тампон помещают в пробирку со стерильной водой или физраствором, встряхивают и просматривают в микроскоп или делают посев на селективные питательные среды. Посевы должны проводиться не позже 4 ч с момента их отбора. До анализа смывы должны храниться при температуре не выше 4-5 ºС.