ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
Национальный стандарт Российской Федерации
ГОСТ Р ИСО 20743-2012
МАТЕРИАЛЫ ТЕКСТИЛЬНЫЕ
Определение антибактериальной активности
изделий с антибактериальной обработкой
ISO 20743:2007
Textiles – Determination of antibacterial activity
of antibacterial finished products
(IDT)
Издание официальное
Москва
Стандартинформ
2014
Предисловие
1 ПОДГОТОВЛЕН Техническим комитетом по стандартизации ТК 442 «Хлопок», Открытым акционерным обществом «Центральный Научно-исследовательский текстильный институт» (ОАО «ЦНИТИ») на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Управлением технического регулирования и стандартизации Федерального агентства по техническому регулированию и метрологии
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. № 1538-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 20743:2007 «Материалы текстильные. Определение антибактериальной активности изделий с антибактериальной обработкой» (ISO 20743:2007 «Textiles – Determination of antibacterial activity of antibacterial finished products»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ. 2014
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Меры предосторожности
5 Оборудование
6 Реагенты и питательные среды
7 Эталонные штаммы
8 Количественные измерения
9 Метод перемешивания
10 Процедуры испытаний
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Библиография
ГОСТ Р ИСО 20743—2012
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МАТЕРИАЛЫ ТЕКСТИЛЬНЫЕ
Определение антибактериальной активности изделий с антибактериальной обработкой
Textiles, Determination of antibacterial activity of antibacterial finished products
Дата введения — 2014—01—01
1 Область применения
Настоящий стандарт устанавливает количественные методы испытаний по определению антибактериальной активности текстильных изделий, в том числе нетканых полотен, прошедших антибактериальную обработку.
Настоящий стандарт применим ко всей текстильной продукции, включая одежду, материалы для набивки, нити и материалы для одежды, товары для дома и другие товары с любым используемым антибактериальным агентом (органическим, неорганическим, натуральным или искусственным), нанесенным любым методом (либо присутствующим по своей природе, либо после окончательной обработки, либо заражением).
С учетом назначения применения, а также окружающей среды, в которой будет использоваться текстильное изделие, исследователь выбирает оптимальный метод испытаний из следующих трех методов определения антибактериальной активности:
- метод абсорбции (поглощения) (оценочный метод, в котором бактериальную суспензию для испытаний вносят непосредственно на образцы);
- метод переноса (оценочный метод, в котором используемые бактерии вносят в чашку Петри с агаровой средой, а затем переносят на образцы);
- метод отпечатков [оценочный метод, в котором бактерии, используемые в испытании, помещают на фильтре и затем переносят (отпечатывают) на образцы].
Чашечный метод подсчета числа колоний и определения интенсивности АТФ (аденозин трифосфат) люминесценции бактерий также являются специфичными для подсчета численности бактерий.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий международный стандарт:
ИСО 6330 Материалы текстильные. Режимы домашней стирки и сушки для текстильных испытаний (ISO 6330, Textiles – Domestic washing and drying procedures for textile testing)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 полотно текстильное (textile fabric): Общий термин для обозначения текстильных поверхностей, нетканых полотен, трикотажных полотен и т. д., образуемых посредством переплетений текстильных волокон и нитей, имеющих определенное сцепление (когезию), в основном используемых для одежды или мебельного применения.
Примечание — Часто включает определенные виды нетканых полотен.
3.2 контрольное полотно (control fabric): Полотно, используемое для подтверждения условий роста эталонных бактерий при испытаниях.
Примечание — Испытывают тот же самый образец полотна, что и для испытаний, только без антибактериальной обработки. Если это возможно, то берется 100% хлопковое полотно без флюоресцирующей отделки (без оптического отбеливателя) и другой обработки.
3.3 антибактериальный агент (anabacterial agent): Продукт, предназначенный для предотвращения или замедления роста бактерий, для уменьшения числа бактерий или уничтожения бактерий.
3.4 антибактериальная отделка (antibacterial finish): Обработка, специально разработанная для предотвращения или замедления роста бактерий, для уменьшения числа бактерий или уничтожения бактерий.
3.5 антибактериальная активность (antibacterialactivity): Активность антибактериальной отделки, служащая для предотвращения или замедления роста бактерий, для уменьшения числа бактерий или уничтожения бактерий.
3.6. чашечный метод подсчета числа колоний (platecountmethod): Метод, в котором число бактерий после инкубации вычисляют подсчетом числа колоний в соответствии с методом десятикратных разведений.
Примечание — Результаты выражаются в «КОЕ (колониеобразующая единица)».
3.7. метод люминесценции (luminescencemethod): Метод, при котором измеряется количество АТФ, содержащееся в бактериальных клетках.
3.8. нейтрализатор (neutralizer): Химические агенты, используемые для дезактивации, нейтрализации или подавления антибактериальных свойств антибактериальных агентов.
4 Меры предосторожности
Данные методы испытаний проводятся с использованием бактерий
Поэтому испытания должны осуществляться обученным и подготовленным персоналом, владеющим микробиологическими методами.
Приведенные меры предосторожности должны быть согласованы в соответствии с особенностями законодательства той страны, в которой проводятся испытания.
5 Оборудование
Используют следующее стандартное лабораторное оборудование.
5.1. Спектрофотометр с измерением длины волны в пределах 620-660 нм или нефелометр McFarland.
5.2. Термостат, предназначенный для поддержания постоянной температуры (37 ± 2) °С.
5.3. Водяные бани, одна — для поддержания постоянной температуры (46 ± 2) °С. другая — для поддержания температуры в диапазоне от 70 °С до 90 °С.
5.4. Миксер, осуществляющий вихревое перемешивание.
5.5. Гомогенизатор, функционирующий со скоростью 6-8 циклов/с, с соответствующими сменными контейнерами.
5.6. Чистый стол для микробиологических испытаний.
5.7. Стиральная машина, отвечающая требованиям ИСО 6330.
5.8. Камера влажности: тропическая камера или другое устройство, способное поддерживать атмосферные условия с высокой влажностью.
5.9. Люминесцентный фотометр, предназначенный для измерения концентраций АТФ (аденозин трифосфат) от 10-13 до 10-7 моль/л при длине волны в диапазоне от 300 до 650 нм с реагентом, используемым для измерения люминесценции.
5.10. Аппарат для получения отпечатков, способный оказывать давление 4 H на испытуемый кусок образца с возможностью вращения образца на 180° в одном направлении в течение 3 с.
5.11. Холодильник, обеспечивающий поддержание температуры а диапазоне от 2 °С до 8 °С.
5.12. Морозильные камеры, одна — для температуры ниже минус 70 °С, другая – для температуры ниже минус 20°С.
5.13. Весы точностью измерения до 0,01 г.
5.14. Фильтровальный аппарат, состоящий из верхнего контейнера, снабженного мембранным фильтром, и нижнего контейнера с отверстием для откачивания.
5.15. Пипетки соответствующих объемов для каждого испытания, с наконечниками из стекла или пластика и погрешностью от 0,5% и менее.
5.16. Флаконы: 30-миллитровые стеклянные колбы с откручивающейся крышкой из полипропилена, поликарбоната либо другого подобного материала, снабженные прокладкой из силикона или тефлона.
5.17. Чашки Петри, стерилизованные, из стекла или пластика, диаметром 90-100 мм и 55-60 мм.
5.18. Стеклянная палочка диаметром приблизительно 18 мм.
5.19. Антиударные зерна (стеклянные бусы) диаметром приблизительно 3-4 мм.
5.20. Колба Эрленмейера объемом 100 мл.
5.21. Обрезное лекало, изготовленное из стерилизующегося материала (нержавеющая сталь или стекло) диаметром (3,8 ± 0,1) см.
5.22. Одноразовые пакеты из пластика, предназначенные для хранения пищевых продуктов, которые могут быть использованы для хранения образцов.
5.23. Пинцеты, изготовленные из материала, который может быть подвергнут стерилизации.
5.24. Цилиндр из нержавеющей стали, массой (200 ± 10) г и диаметром (3,5 ± 0,1) см.
5.25. Металлическая сетчатая корзина для автоклавирования.
5.26. Алюминиевая фольга.
6 Реагенты и питательные среды
Реагенты, используемые для испытаний, должны быть аналитической чистоты (ч. а.) и/или пригодными для микробиологических целей.
Для приготовления питательных сред рекомендуется использовать сухие питательные среды, присутствующие на коммерческом рынке. При приготовлении этих сред необходимо строго следовать инструкциям изготовителя.
6.1 Вода
Вода, используемая для испытаний, должна быть аналитически чистой для микробиологических целей, свежей дистилляции и/или ионообменной, и/или ультрафильтрованной, и/или фильтрованной с помощью обратного осмоса. Вода не должна содержать токсических и каких-либо других веществ, задерживающих рост бактерий.
6.2 Триптон-соевый бульон (ТSВ)
Этот бульон должен быть использован для оживления лиофилизированных штаммов бактерий
Триптон, панкреатический гидролизат казеина.................................... 15 г
Соевый пептон, папаиновый гидролизат сои......................................... .5 г
Хлористый натрий (NaCl)................................................................................ 5 г
вода.............................................................................................................................. 1000 мл (до полного объема)
рН после стерилизации..................................................................................... 7.2 ± 0.2
6.3 Триптон-соевый агар (ТSА)
Триптон, панкреатический гидролизат казеина….15 г
Соевый пептон, папаиновый гидролизат сои____ …...5 г
Хлористый натрий (NaCl)........................... ……………………...5 г
Агар..................................................................................................... …................. ...15 г
Вода............................................................................................................................. 1000 мл (до полного объема)
рН после стерилизации.................................................................................... 7,2 ± 0.2
6.4 Агар для переноса
Тритон, панкреатический гидролизат казеина..................................... …0,75 г
Соевый пептон, папаиновый гидролизат сои……..0,25 г
Хлористый натрий (NaCl)................................................................................ …5 г
Агар............................................................................................................................. …15 г
Вода............................................................................................................................. ..1000 мл (до полного объема)
рН после стерилизации..................................................................................... …7,2 ± 0,2
6.5 Питательный бульон (NB broth)
Мясной экстракт.................................................................................................... ..3 г
Пептон........................................................................................................................ ..5 г
Вода............................................................................................................................. 1000 мл (до полного объема)
рН после стерилизации..................................................................................... 6,9 ± 0,2
6.6 Пептонно-солевой раствор
Триптон, панкреатический гидролизат казеина.................................... 1 г
Натрий хлор (NaCl)............................................................................................. 8,5 г
Вода............................................................................................................................. 1000 мл (до полного объема)
рН после стерилизации..................................................................................... 6,9 ± 0,2
6.7 Физиологический раствор
Натрий хлор (NaCl)............................................................................................. 8,5 г
Вода............................................................................................................................. 1000 мл (до полного объема)
6.8 Среда SCDLP
Пептон, гидролизат казеина............................................................................ 17 г
Пептон, гидролизат соевых бобов............................................................... 3 г
Хлористый натрий (NaCl)................................................................................ 5 г
Калия дигидрофосфат........................................................................................ 2,5 г
Глюкоза..................................................................................................................... 2,5 г
Лецитин..................................................................................................................... 1 г
Твин 80 (Полисорбат 80).................................................................................. 7 г
Вода............................................................................................................................. 1000 мл (до полного объема)
рН после стерилизации..................................................................................... 7,2 ± 0,2
Если уровень нейтрализации недостаточен, содержание полисорбата 80 или лецитина может быть изменено или использован другой нейтрализирующий агент. Однако использование другого нейтрализатора должно быть отражено в протоколе испытаний вместе с данными о его концентрации.
6.9 Буферный раствор для отмывания бактериальной взвеси
Данный буферный раствор состоит из 0,005 моль/л дигидрофосфата натрия, содержащего 0,037% сахарозы.
рН.................................................................................................................................. 7,2 ±0,2
6.10 Нейтрализующий раствор
Состав стандартного нейтрализующего раствора должен быть следующим:
Твин 80 (Полисорбат 80).................................................................................. 30 г
Лецитин яичного желтка.................................................................................. 3 г
Гистидин гидрохлорид...................................................................................... 1 г
Мясной или казеиновый пептон................................................................... 1 г
Хлористый натрий (NaCl)................................................................................ 4,3 г
Калия монофосфат.............................................................................................. 3,6 г
Двунатриевый фосфат дигидрат................................................................... 7,2 г
Вода............................................................................................................................. 1000 мл (до полного объема)
Если эффективная нейтрализующая сила не может быть достигнута, содержание полисорбата 80 или лецитина может быть изменено или использован другой нейтрализирующий агент. Использование другого нейтрализатора должно быть отражено в протоколе испытаний с указанием его концентрации
6.11 Агар для подсчета колонии (ЕА)
Сухой экстракт дрожжей………………………….2,5 г
Казеиновый триптон………………………......... 5,0 г
Глюкоза............................................ ….............................. ……………....1 г
Агар........................................... .................................................................................... От 12 г до 18 г (в зависимости от крепости гелеобразного продукта)
Вода.......................................... …………………………………1000 мл (до полного объема)
рН после стерилизации........................................................................................ 7,2 ± 0,2
6.12 Агар для получения отпечатков
Агар........................................................ ....................................................................... 20 г
Вода............................................................................................................................... 1000 мл (до полного объема)
6.13 Раствор, защищающий бактерии определенных видов от низких температур
Для замораживания бактерий используется раствор, защищающий от низких температур. Раствор содержит 150 г/л глицерина или 100 г/л диметилсульфооксида.
Для растворов, содержащих глицерин, готовят питательный раствор, а затем добавляют 150 г глицерина на 1 л и затем раствор стерилизуют.
Для растворов, содержащих диметилсульфооксид, стерилизацию диметилсульфооксида осуществляют пропусканием последнего через мембранный фильтр размерами пор 0,22 мкм. Затем готовят питательный раствор, стерилизуют его и добавляют пропущенный через мембранный фильтр диметилсульфооксид, добавляя 100 г препарата на 1 л питательного раствора.
Примечание — Пригоден любой другой коммерчески разработанный способ, позволяющий сохранить штаммы, аналогично описанному выше методу, как с использованием раствора, защищающего от низких температур, так и предохраняющей системы, содержащей глицерин или диметилсульфооксид.
Реагенты, используемые в данных испытаниях, должны быть аналитического качества и/или быть пригодными для микробиологических целей.
6.14 Основной раствор стандартного реагента АТФ
5 трифосфат аденозин-двунатрия тригидрат........................................... 59,7 мг
Вода......................... ……………………………………….1000 мл (до полного объема)
После приготовления раствор должен быть помещен в плотно закрытый контейнер и храниться в криогенных условиях при температуре минус 20 °С и ниже. Раствор может быть использован не позднее чем через 6 мес после его приготовления.
6.15 Буферный раствор для люминесцирующего реагента АТФ
Трис(гидроксиметил)аминометан................................................................ …760 мг
Дигидрат тетраацетата двунатрия этилендиамина..370 мг
Тетрагидрат ацетата магния............................................................................ ….800 мг
DL-дитиотреитол...................................................................... ……………..8 мг
Вода............................................................................................................................. …..250 мл (до полного объема)
рН.................................. …………………………………….......7,5 ± 0,2
Этот реагент должен быть использован не позднее чем через 8 ч после приготовления
6.16 Люминесцирующий реагент АТФ
Люцифераза (ЕС: 1.13.12.7) .......................................................................... ..10 мг
D-люциферин.................... ………………………………….15 мг
Альбумин бычьей сыворотки........................................................................... 60 мг
Буферный раствор по 6.15................................................................................. 30 мл (до полного объема)
После растворения реагент должен храниться при комнатной температуре не менее 15 мин перед применением, а затем быть использован в течение 3 ч.
6.17 АТФ реагент для экстракции
10%-ный водный раствор бензалкония хлорида................................... .1 мл
Вода.................................. …………………………………….9 мл
Использование любого другого неспецифичного реагента для экстракции должно быть отражено в протоколе испытаний.
6.18 АТФ элиминирующий агент
Агент, который уменьшает концентрацию АТФ в питательном бульоне до уровня менее чем 10-13 моль/л в течение 15 мин.
Апираза (ЕС: 3.6.1.5).......................................................... .5 международных единиц
Аденозиндезаминаза (фермент) (ЕС: 3.5.1.4).......................................... .5 международных единиц
Буферный раствор 0,005 моль/л натрия фосфорнокислого 2-водного
с содержанием сахарозы…………………………..10 мл (до полного объема)
рН……………………………………………………7,2 ± 0,2
Использование любого другого неспецифического нейтрализующего реагента должно быть отражено в протоколе испытаний.
6.19 SCDLP или другая среда для приготовления эталонного раствора АТФ
SCDLP по п. 6 8 или другая среда................................... ……………10 мл
Элиминирующий агент АТФ по 6.18............................ …………….1 мл
После перемешивания помещают в термостат на 1 ч при температуре от 30 °С до 37 °С для предотвращения микробиологической контаминации.
Затем переносят на 1 ч в горячую водяную баню при температуре от 70 °С до 90 °С и затем охлаждают до комнатной температуры.
Хранят раствор в холодильнике и используют в течение 24 ч после приготовления.
Эталонный раствор АТФ следует готовить в том случае, если добавление нейтрализующих агентов вызывает увеличение концентрации АТФ в отмывочном растворе более 10-11 моль/л.
7 Эталонные штаммы
7.1 Штаммы
Следующие штаммы должны использоваться во всех испытаниях антибактериальной активности:
- Staphylococcus aureus АТСС 6538, CIP 4.83, DSM 799, NBRC 13276 или NCIMB 9518;
- Klebsiella pneumoniae АТСС 4352, CIP 104216, DSM 789, NBRC 13277 или NCIMB 10341.
Примечание — АТСС — обозначение Американской коллекции типовых культур (American Type Culture Collection) (США); CIP — обозначение коллекции культур Института Пастера (Франция); DSM — обозначение культур Германской коллекции микроорганизмов и клеточных культур (Germar Colection of Microorganism and Cell Cultures) (Германия); NBRC — обозначение культур Центра Nite Биологических ресурсов (Biological Resource Center) (Япония); NСIMB — обозначение культур Национальной коллекции промышленных бактерий (National Collection of Industrial Bacteria) (Великобритания).
По согласованию всех заинтересованных сторон допускается использование эквивалентных штаммов бактерий вместо вышеприведенных штаммов, которые могут быть получены из Всемирной Федерации Коллекции Культур [World Federation of Culture Collection (WFCC)]. Штаммы, используемые в испытаниях, должны фигурировать в документах с обозначением как наименований используемых штаммов, так и источников их происхождения.
7.2 Хранение штаммов
7.2.1 Общие положения
Штаммы необходимо хранить в соответствии с рекомендациями изготовителей или требованиями ЕН 12353.
В документах должны быть приведены данные об идентификации и происхождении коллекции культур штаммов, а также о способе их хранения в лаборатории.
7.2.2 Метод с использованием керамических гранул (бус)
Получают образец с лиофилизированными бактериями определенного штамма, следуя инструкциям, прилагаемым к данному штамму. Ресуспензируют образец в 5 мл буферного раствора TSB (см. 6.2). Получают образец суспензии и вносят его в чашку Петри (см. 5.17), содержащую TSA (см. 6.3). Инкубируют культуры в течение 18-24 ч при температуре (37 ± 2) °С.
После инкубации используют культуру, изолированную с чашки Петри, для проверки ее чистоты.
После проверки готовят основную культуру.
Берут 0,7 мл образца бульонной культуры и распределяют его по поверхности чашки Петри, содержащей TSA. Выращивают культуру на чашке Петри с TSA в течение 18-24 ч при определенных для данного штамма условиях.
Добавляют 10 мл раствора, защищающего от низких температур (см. 6.13), на поверхность чашки Петри с TSA культурой и ресуспендируют клетки в растворе, используя стерильный стеклянный шпатель. Образец ресуспендированных клеток с поверхности агара разводят в 100 мл раствора, защищающего от низких температур, и инкубируют в течение 30 мин при температуре 20 °С.
Используя пипетку (см. 5.15), 1 мл суспензии переносят в криогенную колбу (см. 5.16), содержащую бусы (см. 5.19). Колбу встряхивают таким образом, чтобы распределить клеточную бактериальную взвесь по бусам.
- Если раствор, защищающий от низких температур, содержит диметилсульфооксид, не следует оставлять его более чем на 1 мин при комнатной температуре.
- Раствор, защищающий от низких температур, содержащий глицерин, оставляют на 30 мин при температуре 20 °С.
- Стерильной пипеткой удаляют излишки раствора, защищающего от низких температур. Помещают колбы в морозильную камеру (см. 5.12) температурой минус 70 °С или ниже.
Используя метод последовательных (серийных) разведений, готовят разведения суспензии 10-6 и 10-7. По 1 мл образца каждого разведения вносят в отдельные чашки Петри. Добавляют 12-15 мл питательного раствора, охлажденного до температуры (45 ± 1) °С. Инкубируют в течение 18-24 ч при условиях, установленных для данного штамма. Подсчитывают число бактерий на чашке Петри, чтобы удостовериться, что суспензия содержит менее чем 5 ∙108 КОЕ/мл.
Хранят криогенную колбу в морозильной камере при температуре ниже минус 70 °С.
7.2.3 Метод суспензии с глицерином
Инокулируют свежевыращенную изолированную колонию в пробирку объемом 15 мл, содержащую 5 мл соответствующей среды. Проводят инкубацию в термостате при температуре 37 °С до наступления поздней логарифмической или стационарной фазы (обычно от 5 ч инкубации и до инкубации в течение ночи).
Для каждого из штаммов, который хранится при температуре ниже минус 70 °С, готовят стерильную, снабженную ярлыком пробирку для низких температур.
В пробирку наливают 225 мкл стерильного 80%-ного глицерина. Затем в нее вносят 1,0 мл бактериальной культуры (замороженный образец должен содержать 15% глицерина). Тщательно перемешивают, используя миксер (см. 5.4). Культуру хранят в пробирке при температуре минус 70 °С и ниже.
Для хранения любого из штаммов при температуре ниже минус 20 °С используют жидкий глицерин. В маркированную полипропиленовую пробирку для низких температур вносят равные объемы 80%-ного глицерина и бактериальной культуры. Для предотвращения образования ледяных кристаллов, уменьшающих жизнеспособность клеток бактерий, взвесь в пробирке тщательно перемешивают. Помещают пробирку в морозильную камеру при температуре минус 20 °С. Через 1 неделю, по возможности, проверяют жизнеспособность клеток бактерий.
Для оживления штамма после хранения в глицерине при температуре минус 70 °С используют стерильную зубочистку, чтобы отделить частичку твердого вещества. Затем штрихом высевают клетки в соответствующую среду. Не следует замораживать данный образец вновь, так как каждый цикл замораживания/размораживания приводит к 50% потере жизнеспособности клеток (бактерий).
Для получения ночной культуры из рабочего раствора, хранящегося при температуре минус 20°С, вносят пипеткой 50-100 мкл стерильного 80%-ного глицерина в 5 мл питательной среды.
7.2.4 Идентификация штамма
Для идентификации штамма проводят проверку в соответствии с общепринятыми методами идентификации.
Для каждого бактериального штамма предусматривается запись следующей информации:
а) наименование национальной коллекции культур, из которой были получены лиофилизированные штаммы;
b) таксономическое наименование по классификации и соответствующий номер лиофилизированного штамма;
c) номер партии лиофилизированного штамма, полученной из национальной коллекции культур;
d) дата выращивания лиофилизированного штамма;
е) дата приготовления культуры для хранения;
f) лабораторный код сохраняющейся культуры.
Должна быть сделана запись об использованных методах, применяемых для проверки чистоты и идентификации штамма, даты проведения и результаты таких проверок.
8 Количественные измерения
8.1 Чашечный метод подсчета числа колоний
8.1.1 Используя пипетку (см. 5.берут 1 мл суспензии и добавляют в пробирку, содержащую (9,0 ± 0,1) мл питательного бульона (см. 6.5) или пептонно-солевого раствора (см. 6.6). Смесь тщательно встряхивают.
8.1.2 Используя новую пипетку, переносят 1 мл полученного раствора в новую пробирку, содержащую (9,0 ± 0,1) мл среды и вновь тщательно встряхивают. Последовательно повторяя процедуру, выполняют серию разведений таким образом, чтобы общее число разведений составляло 10. По 1 мл каждого разведения переносят пипеткой в две чашки Петри.
8.1.3 На водяной бане (см. 5.3) подогревают примерно 15 мл агара для подсчета числа колоний (ЕА) (см. 6.11) до температуры от 45°С до 46°С и наливают в чашки Петри, тщательно перемешивая. Чашки выдерживают при комнатной температуре до затвердевания агаровой среды, затем их переворачивают и помещают в термостат при температуре (37 ± 2) °С и проводят инкубацию в течение 24-48 ч.
8.1.4 После инкубации подсчитывают число колоний на чашках Петри в тех разведениях, где можно сосчитать от 30 до 300 КОЕ, и вычисляют концентрацию бактерий в растворе по следующей формуле:
CВ = ZR,
где СВ – концентрация бактерий в колониеобразующих единицах на миллилитр. КОЕ/мл;
Z – среднее число в колониеобразующих единицах КОЕ на двух чашках Петри;
R – степень разведения.
8.2 Метод люминесценции
8.2.1 Формула для калибровочной кривой
8.2.1.1 Берут стандартный препарат АТФ (см. 6.14), физиологический раствор (см. 6.7), среду SCDLP (см. 6.8) либо другую подходящую среду и готовят три отдельных раствора, содержащие до 2∙10-8 моль/л, 2∙10-9 моль/л и 2∙10-10 моль/л АТФ соответственно.
8.2.1.2 Наливают по 0,1 мл каждого раствора, приготовленных по 8.2.1.1, в три отдельные испытательные пробирки. В каждую пробирку добавляют по 0,9 мл буферного раствора (см. 6.9) и тщательно взбалтывают. Наливают по 0,1 мл каждого раствора отдельно в три испытательные пробирки и обозначают их как образцы для измерения разведенного стандартного реагента.
8.2.1.3 Наливают в пластиковую пробирку для испытаний 0,1 мл физиологического раствора (см. 6.7), SCDLP (см. 6.8) или другой подходящей среды, 0,8 мл буферного раствора (см. 6.9) и 0,1 мл АТФ нейтрализующего агента (см. 6.18). Тщательно взбалтывают, а затем наливают по 0,1 мл в три отдельные пробирки для испытаний. Выдерживают от 5 до 30 мин и обозначают как образцы для измерения.
8.2.1.4. В испытательную пробирку, содержащую образец для измерения, добавляют 0,1 мл порции АТФ экстрагирующего реагента (см. 6.17) и встряхивают. Добавляют 0,1 мл АТФ люминесцирующего реагента (см. 6.16), снова взбалтывают и, немедленно используя люминесцентный фотометр (см. 5.9), определяют количество люминесценции.
8.2.1.5 Добавляют к образцам для измерения разведенного стандартного реагента 0,1 мл АТФ экстрагирующего реагента (см. по порядку начиная с наименьшей концентрации, и встряхивают, а затем немедленно используют люминесцентный фотометр (см. определяя количество люминесценции.
8.2.1.6 Вычисляют концентрацию АТФ посредством среднего количества люминесценции, полученной при измерении различных разведений стандартного реагента (2∙10-8 моль/л, 2∙10-9 моль/л и 2∙10-10 моль/л), и учета этих значений как среднего значения коэффициента А.
8.2.1.7 Получают коэффициент В замещением коэффициента А, подставляя САТФ = 0 в следующую формулу для калибровочной кривой:
САТФ= АХ + В,
где САТФ — концентрация АТФ в моль на литр (моль/л);
X — количество люминесценции в относительных единицах света.
Примечание — Коэффициент корреляции между САТФ и X равен R2 ≥ 0,9 и доверительный интервал > 0,95.
8.2.2 Концентрация АТФ бактериальной суспензии
8.2.2.1 Готовят одну пробирку для нейтрализации АТФ и три испытательные пробирки для измерений.
8.2.2.2 Наливают 0,1 мл перемешанной бактериальной суспензии, 0,8 мл буферного раствора для разведений (см. 6.9) и 0,1 мл АТФ нейтрализующего агента (см. 6.18) в испытательную пробирку, предназначенную для элиминации (устранения) АТФ, и тщательно перемешивают. Наливают по 0,1 мл раствора в три испытательные пробирки, подготовленные для измерений, и выдерживают их от 5 до 30 мин.
8.2.2.3 Добавляют 0,1 мл реагента для экстракции АТФ (см. 6.17) в каждую из пробирок и тщательно взбалтывают. Добавляют 0,1 мл АТФ люминесцирующего агента (см. 6.16), повторно взбалтывают и немедленно же используют люминесцентный фотометр (см. 5.9), определяя количество люминесценции.
8.2.2.4 Вычисляют концентрацию АТФ САТФ по формуле, приведенной в 8.2.1.7, а затем рассчитывают концентрацию АТФ в отмытой бактериальной суспензии в соответствии со следующей формулой;
САТФ = САТФ/1000,
где САТФ — концентрация АТФ, моль/л, в перемешанной бактериальной суспензии.
9 Метод перемешивания
9.1 Перемешивание вихревым миксером
Для испытательной пробирки прижимают к резиновой пластине держателя вихревого миксера (см. 5.4) и перемешивают 5 раз по 5 с.
9.2 Перемешивание вручную
Берут испытательную пробирку или колбу в руку и встряхивают с амплитудой качания 30 см в течение 30 с.
9.3 Перемешивание в гомогенизаторе Стомахер
Помещают заранее подготовленный одноразовый пластиковый пакет (см. 5.22) в гомогенизатор Стомахер (см. 5.5) и включают устройство на 1 мин для каждой из сторон пакета.
10 Процедуры испытаний
10.1 Метод абсорбции
10.1.1 Инкубация и приготовление посевного материала для испытаний
10.1.1.1 Инкубация А
Проводят отбор бактерий, находящихся в контейнере для хранения, используя бактериальную петлю. Культуру бактерии высевают штрихом на чашку с агаром ЕА и инкубируют при температуре (37 ± 2) °С в течение 24-48 ч.
Примечание — Чашки хранятся при температуре 5°С – 10°С и должны использоваться не более чем через 1 неделю после приготовления.
10.1.1.2 Инкубация В
Наливают 20 мл питательного бульона (см. 6.5) или триптон соевого бульона (см. 6.2) ТSВ в коническую колбу Эрленмейера объемом 100 мл. С помощью бактериальной петли отбирают одну колонию после инкубации А, как описано в 10.1.1.1, и засевают колонию в бульон. Инкубируют посевной материал в следующих условиях:
- температура: (37 ± 2) °С:
- степень встряхивания: 110 мин-1 с амплитудой 3 см;
- время инкубации: от 18 до 24 ч.
10.1.1.3 Инкубация С
Наливают 20 мл питательного бульона (см. 6.5) или триптон соевого бульона (см. 6.2) ТSВ в коническую колбу Эрленмейера объемом 100 мл. Добавляют 0,4 мл посевного материала из инкубации В, как описано в 10.1.1.2, которая содержит в бульоне от 1∙108 до 3∙108 КОЕ/мл или АТФ в концентрации от 1∙10-6 до 3∙10-6 моль/л, и осуществляют инкубацию в следующих условиях:
- температура: (37 ± 2) °С;
- степень встряхивания: 110 мин-1 с амплитудой 3 см;
- время инкубации: (3 ± 1) ч.
Целью является получение концентрации КОЕ или АТФ после инкубации в значениях 107 КОЕ/мл или 10-7 моль/л АТФ соответственно.
Примечание — Полученный посевной материал следует хранить на льду и использовать в течение 8 ч.
10.1.1.4 Приготовление посевного материала
Готовят концентрацию бактерий от 1∙105 до 3∙105 КОЕ/мл, используя спектрофотометр или нефелометр МсFarland) (см. 5.1) или устанавливают концентрацию АТФ от 1∙10-9 до 3∙10-9 моль/л люминесцентным методом, используя питательный бульон (см. 6.5), разведенный в 20 раз водой при комнатной температуре
Примечание — Полученный посевной материал следует хранить на льду и использовать в течение 4 ч.
10.1.2 Приготовление образцов для испытаний
10.1.2.1 Масса и форма образцов для испытаний
Берут куски образцов массой по (0,40 ± 0,05) г, обрезают их до размеров, удобных для проведения испытаний. Берут шесть тестовых образцов контрольного полотна и шесть образцов для испытаний с антибактериальной обработкой.
Примечание — Для начала учета сразу после заражения используют три контрольных образца и три образца с антибактериальной обработкой. Оставшиеся образцы применяют только после инкубации в течение 18-24 ч.
10.1.2.2 Установка испытательных образцов
Помещают каждый из образцов для испытаний в отдельную емкость и, исходя из свойств образца, выбирают один из следующих методов:
- если испытуемый образец полотна легко распадается на нити, набивной или имеет подложку, на образец, находящийся в емкости, помещают стеклянные шарики (см. 5.18). Также можно обработать края испытуемого образца нитями во избежание роспуска;
- если испытуемым образцом является пряжа, то ее укладывают в емкость мотком и на моток сверху кладут стеклянные шарики;
- если испытуемым образцом является ковровая ткань или аналогичный материал, то обрезают ворс и также располагают в емкости поверх образца стеклянные шарики.
Если требуется, то образцы для испытаний могут быть выстираны в соответствии с методом, изложенным в ИСО 6330, или другим подходящим методом. После завершения стирки образцы ополаскивают водой для нейтрализации моющих веществ. При использовании каких-либо нестандартных методов испытаний необходимо отметить это в протоколе испытаний.
Если необходимо, то образец для испытаний проходит стерилизацию в автоклаве по следующей процедуре:
1) накрывают верхнюю часть емкости, содержащей испытуемые образцы, алюминиевой фольгой (см. 5 26);
2) помещают покрытую алюминиевой фольгой емкость в металлическую сетчатую корзину (см. 5.25) для автоклавирования;
3) заворачивают крышки емкостей в алюминиевую фольгу и помещают их в металлическую сетчатую корзину.
4) стерилизуют крышки и емкости с испытуемыми образцами в автоклаве при температуре 121 °С и давлении 103 кПа в течение 15-20 мин;
5) после стерилизации удаляют алюминиевую фольгу и дают возможность испытуемому образцу в емкости подсохнуть в течение 60 мин или более, оставив на лабораторном столе (см. 5.6) или в другом месте, где отсутствует возможность заражения от циркулирующего воздуха;
6) плотно закрывают емкость крышкой.
Если автоклавирование невозможно, то стерилизацию можно осуществить с помощью газа этилен оксида, гамма-лучами и другими соответствующими методами. Использование альтернативных методов должно быть отмечено в протоколе испытаний.
10.1.3 Протокол испытания
10.1.3.1 Нанесение посевного материала на испытуемые образцы
Аккуратно наносят по 0,2 мл посевного материала, приготовленного по 10.1.1.4, в несколько точек каждого испытуемого образца, подготовленного по 10.1.2.2, не допуская попадания посевного материала на поверхность емкости, и затем емкость закрывают крышкой.
10.1.3.2 Встряхивание после заражения посевным материалом
Сразу после заражения по 10.1.3.1 добавляют 20 мл SCDLP среды (см. 6.8) в каждую из шести емкостей, в которые помещены контрольные образцы ткани и испытуемые образцы с антибактериальной обработкой. Емкости закрывают крышками и встряхивают, как описано в разделе 9.
10.1.3.3 Инкубация
Проводят инкубацию в емкостях (три испытуемых образца контрольной ткани, три образца с антибактериальной обработкой) при температуре (37 ± 2) °С в течение 18-24 ч.
10.1.3.4 Встряхивание после инкубации
После инкубации по 10.1.3.3 добавляют 20 мл среды SCDLP (см. 6.8) в каждую емкость, плотно закрывают крышками и встряхивают, как описано в разделе 9.
10.1.3.5 Подсчет числа бактерий или количества АТФ
10.1.3.5.1 Основные положения
Получают число бактерий или количество АТФ, как описано в 10.1.3.2 и 10.1.3.4, исходя из концентрации бактерий или концентрации АТФ, полученных в соответствии с разделом 8 согласно формулам, приведенным в 10.1.3.5.2 и 10.1.3.5.3 соответственно.
10.1.3.5.2 Число бактерий
М = СВ ∙ 20.
где М — число бактерий на образце;
СВ — концентрация бактерий, полученная по 8.1;
20 — объем встряхиваемого раствора, в миллилитрах (мл).
10.1.3.5.3 Количество АТФ
М' = САТФ ∙ 20,
где М' — количество АТФ на образец;
САТФ — концентрация АТФ, полученная по 8.2;
20 — объем встряхиваемого раствора, в миллилитрах (мл).
10.1.4 Результаты испытаний
10.1.4.1 Оценка эффективности испытаний
Если условия перечислений а), b) и с) или а), b) и d) удовлетворительны, то испытания можно признать эффективными. Если испытания признаны неэффективными, то испытания необходимо провести повторно.
а) Посевной материал для испытаний по 10.1.1.4 должен содержать от 1∙105 до 3∙105 КОЕ/мл, а концентрация АТФ должна быть от 1∙10-9 до 3∙10-9 моль/л.
b) Различия в крайних значениях для трех контрольных полотен сразу же после заражения и после инкубации должны составлять lg≤ 1.
с) Уровень роста, полученный в соответствии со следующей формулой должен быть более или равен 1 при использовании чашечного метода подсчета числа колоний.
d) Уровень роста, полученный согласно следующей формуле, должен быть более или равен 0,5 при расчете методом люминесценции:
F = lgCt – lgC0,
где F — уровень роста на контрольном полотне;
lgCt — средний десятичный логарифм числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна после инкубации от 18 до 24 ч;
lgC0 — средний десятичный логарифм числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна сразу же после заражения.
10.1.4.2 Вычисление уровня антибактериальной активности
Когда испытание признано эффективным, получают значение антибактериальной активности согласно следующей формуле:
A = (lgCt – lgC0) – (lgTt – lgT0) = F - G
где А — значение антибактериальной активности;
F – уровень роста на контрольном образце (F = lgCt – lgC0);
G — уровень роста на образце, прошедшем антибактериальную обработку (G = lgTt – lgT0);
lgTt — среднее значение десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний полотен, прошедших антибактериальную обработку, после инкубации в течение 18-24 ч;
lgT0 — среднее значение десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний полотен, прошедших антибактериальную обработку, сразу же после посева.
10.1.4.3 Протокол результатов испытаний
Протокол должен содержать наименования бактерий, используемых для испытаний, номер штамма, концентрацию материала, используемого для заражения, значения антибактериальной активности, метод измерения числа бактерий и тип образца (на примере таблиц 1 и 2).
Также записывают наименования и концентрации любых специальных нейтрализаторов, используемых для растворов при взбалтывании.
Таблица 1 — Пример 1: Результаты испытаний (значение антибактериальной активности методом абсорбции)
| Наименование бактерий для испытаний (номер штамма) |
Staphylococcus aureus (ATCC 6538) |
Klebsiella pneumoniae (ATCC 4352) |
||
| Концентрация материала для заражения (КОЕ/мл) | 1,2∙105 | 1,1∙105 | ||
| Ризница экстремальных значений для трех контрольных полотен (lg) | 0 ч | 20 ч | 0ч | 20 ч |
| 0,4 | 0,3 | 0,5 | 0,4 | |
| Значение роста F (F = lgCt – lgC0) |
+2,7 (lgCt: +7,0; lgC0: +4,3) |
+3,2 (lgCt: +7,5; lgC0: +4,3) |
||
| Значение роста G (G = lgTt – lgT0) |
-1,0 (lgTt: +3,2; lgT0: +4,2) |
+0,7 (lgTt: +4,9; lgT0: +4,2) |
||
| Значение антибактериальной активности (A = F – G) | 3,7 | 2,5 | ||
| Метод измерений | Чашечный метод подсчета числа колоний | |||
| Тип материала образцов |
Носки Хлопок 100% |
|||
| Метод стерилизации | Автоклав | |||
| Время инкубации | 20 ч | |||
Таблица 2 — Пример 2: Результаты испытаний (значение антибактериальной активности методом абсорбции)
| Наименование бактерий для испытаний (номер штамма) |
Staphylococcus aureus (ATCC 6538) |
Klebsiella pneumoniae (ATCC 4352) |
||
| Концентрация материала для заражения (моль/л) | 1,2∙10-9 | 1,9∙10-9 | ||
| Разница экстремальных значений для трех контрольных полотен (lg) | 0 ч | 20 ч | 0 ч | 20 ч |
| 0,5 | 0,6 | 0,5 | 0,4 | |
| Значение роста F (F = lgCt – lgC0) |
+1,7 (lgCt: -11,0; lgC0: -12,7) |
+2,1 (lgCt: -10,4; lgC0: -12,5) |
||
| Значение роста G (G = lgTt – lgT0) |
-0,8 (lgTt: -13,6; lgT0: -12,8) |
-0,1 (lgTt: -12,6; lgС0: -12,5) |
||
| Значение антибактериальной активности (A = F – G) | 2,5 | 2,2 | ||
| Метод измерений | Метод люминесценции | |||
| Тип материала образцов |
Занавеска Полиэфир 100% |
|||
| Метод стерилизации | Газ этиленоксид | |||
| Время инкубации | 20 ч | |||
10.2 Метод переноса
10.2.1 Приготовление посевного материала для испытаний
10.2.1.1 Инкубация штамма для испытаний
Получают штамм из основной культуры, находящейся на хранении, используя бактериальную петлю, высевая штрихом на чашку с триптонсоевым агаром TSA (см. 6.3). Чашку Петри инкубируют при температуре (37 ± 2) °С в течение 18-24 ч. После инкубации колонию отбирают с чашки и высевают штрихом на другую чашку с триптонсоевым агаром TSA. Вновь инкубируют при температуре (37 ± 2) °С в течении 18-24 ч.
Примечание — При втором пересеве создается рабочая культура.
Когда выращивание не может быть выполнено в течение одного дня, для последующего заражения можно использовать 48-часовую культуру бактерий, которая инкубируется в термостате (см. 5.2) в течение 48 ч. В этом случае необходимо предварительно приготовить для испытаний новую 24-часовую субкультуру. Четвертая субкультура при этом не должна использоваться.
10.2.1.2 Приготовление посевного материала для испытаний
Отбирают колонию со второго пересева на триптонсоевом агаре TSA, используя бактериальную петлю, и вносят ее в пептонно-солевой раствор (см. 6.6) и тщательно перемешивают вихревым миксером (см. 5.4). Создают концентрацию бактерий от 1∙108 до 3∙108 КОЕ/мл или концентрацию АТФ от 2∙10-7 до 6∙10-7 моль/л, используя пептонно-солевой раствор (см. 6.6), с помощью метода абсорбции или люминесцентного метода. Разводят посевной материал до концентрации от 1∙106 до 3∙106 КОЕ/мл или до концентрации АТФ от 2∙10-9 до 6∙10-9 моль/л, используя для разведения пептонно-солевой раствор (см. 6.6). Конечное число бактерий проверяют методом, описанным в разделе 8.
10.2.2 Приготовление образцов для испытаний
Используя лекало (см. 5.21), вырезают испытуемые образцы диаметром 3,8 см.
Испытуемые образцы не должны содержать швов, кромок, вышивки, крепежа и т. п.
Необходимо иметь достаточное число образцов для испытаний, вырезанных для одной партии без швов и наметок (минимум 0,5 м2), чтобы можно было провести повторные испытания.
Если необходимо, то испытуемые образцы могут быть выстираны по методу, изложенному в ИСО 6330, или другому соответствующему методу. После окончания стирки образцы ополаскивают водой для удаления моющих средств. Использование любых неспецифичных методов должно быть отражено в протоколе испытаний.
При необходимости испытуемые образцы могут быть стерилизованы в автоклаве, газом этилен оксидом, гамма-лучами или другим подходящим методом. Использование любых неспецифичных методов должно быть отражено в протоколе испытаний.
10.2.3 Проведение испытания
10.2.3.1 Нанесение посевного материала на чашки
Приготавливают 12 чашек с агаровой средой для переноса (см. 6.4). Инокулируют 1 мл посевного материала по 10.2.1.2 на агар, распределяют посевной материал по всей поверхности агара, покачивая чашку из стороны в сторону, чтобы полностью заполнить поверхность агара. Избыточную жидкость отсасывают. Для полного впитывания посевного материала в агар чашки оставляют стоять на лабораторном столе в течение (300 ± 30) с.
10.2.3.2 Перенос на образец
Приготавливают три образца для испытаний контрольного полотна и три образца с антибактериальной обработкой для использования сразу же после переноса и после инкубации соответственно. Каждый образец выкладывают на поверхность агара по 10.2.3.1 и ставят сверху 200-граммовый цилиндр из нержавеющей стали (см. 5.24) на (60 ± 5) с. Каждый образец переносят в чашки Петри (см. 5.17) диаметром 55-60 мм таким образом, чтобы сторона, на которую перенесен посевной материал, была расположена сверху. Проводят инкубацию в камере влажности (см. 5.8) в течение 18-24 ч при температуре (37 ± 2) °С.
10.2.3.3 Встряхивание после переноса
Сразу после переноса каждый образец помещают в стерильный мешочек или в колбу, содержащие 20 мл нейтрализующего раствора (см. 6.10), и встряхивают, как описано в разделе 9.
10.2.3.4 Встряхивание после инкубации
После инкубации каждый образец помещают в стерильный мешочек или в колбу, содержащие 20 мл нейтрализующего раствора (см. 6.10), и встряхивают, как описано в разделе 9.
10.2.3.5 Подсчет числа бактерий или количества АТФ
10.2.3.5.1 Основные положения
Вычисляют число бактерий или количество АТФ. как описано в 10.2.3.2 и 10.2.3.4, исходя из концентрации бактерий или концентрации АТФ, полученных по разделу 8, согласно формулам, приведенным в 10.2.3.5.2 и 10.2.3.5.3 соответственно.
10.2.3.5.2 Число бактерий
М = СВ ∙ 20,
где М — число бактерий в образце;
СВ — концентрация бактерий, полученная по 8.1;
20 — объем встряхивавшегося раствора, в миллилитрах (мл).
10.2.3.5.3 Количество АТФ
М' = САТФ ∙ 20,
где М' — количество АТФ в образце;
САТФ — концентрация АТФ, полученная по 8.2;
20 — объем встряхивавшегося раствора, в миллилитрах (мл).
10.2.4 Результаты испытаний
10.2.4.1 Оценка эффективности испытаний
Если условия перечислений а), b) и с) или а), b) и d) удовлетворительны, испытания можно признать эффективными. Если испытания признаны неэффективными, испытания необходимо провести повторно.
а) Посевной материал для испытаний по 10.2.1.2 должен содержать от 1∙106 до 3∙106 КОЕ/мл, а концентрация АТФ должна быть от 2∙10-9 до 6∙10-9 моль/л.
b) Различия в крайних значениях для трех контрольных полотен сразу же после заражения и после инкубации должны составлять lg не более 1.
с) Уровень роста, полученный в соответствии со следующей формулой, должен быть более и равен 1 при использовании чашечного метода подсчета числа колоний.
d) Уровень роста, полученный согласно следующей формуле, должен быть более и равен 0,5 при использовании метода люминесценции:
F = lgСt – lgС0,
где F — уровень роста на контрольном полотне;
lgСt — средний десятичный логарифм числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна после инкубации в течение 18-24 ч;
lgС0 — средний десятичный логарифм числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна сразу же после переноса на контрольное полотно.
10.2.4.2 Вычисление значения антибактериальной активности
Когда испытание признано эффективным, получают значение антибактериальной активности согласно следующей формуле:
A = (lgCt – lgC0) – (lgTt – lgT0) = F - G
где А — значение антибактериальной активности;
F – уровень роста на контрольном образце (F = lgCt – lgC0);
G — уровень роста на образце, прошедшем антибактериальную обработку (G = lgTt – lgT0);
lgTt — среднее значение десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний полотен, прошедших антибактериальную обработку, после инкубации в течение 18-24 ч;
lgT0 — среднее значение десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний полотен, прошедших антибактериальную обработку, сразу же после переноса.
10.2.4.3 Протокол результатов испытаний
Протокол должны содержать наименования бактерий, используемых для испытаний, номер штамма, число перенесенных бактерий, значения антибактериальной активности, метод измерения числа бактерий и тип образца (на примере таблиц 3 и 4).
Также записывают наименования и концентрации любых специальных нейтрализаторов, используемых для растворов при взбалтывании.
Таблица 3 — Пример 1: Результаты испытаний (значение антибактериальной активности для метода переноса)
| Наименование бактерий для испытаний (номер штамма) |
Staphylococcus aureus (ATCC 6538) |
Klebsiella pneumoniae (ATCC 4352) |
||
| Концентрация посевного материала для заражения (КОЕ/мл) | 2,2 ∙ 106 | 1,1 ∙ 106 | ||
| Разница экстремальных значений для трех контрольных полотен (lg) | 0 ч | 22 ч | 0 ч | 22 ч |
| 0,3 | 0,4 | 0,2 | 0,3 | |
| Значение роста F (F = lgCt – lgC0) |
+2,9 (lgCt: +8,5; lgC0: +5,6) |
+2,2 (lgCt: +8,1; lgC0: +5,4) |
||
| Значение роста G (G = lgTt – lgT0) |
-1,7 (lgTt: +3,8; lgT0: +5,5) |
-2,5 (lgTt: +2,8; lgT0: +5,3) |
||
| Значение антибактериальной активности (A = F – G) | 4,6 | 522 | ||
| Метод измерений | Чашечный метод подсчета числа колоний | |||
| Тип материала образцов |
Носки Хлопок 100% |
|||
| Метод стерилизации | Автоклав | |||
| Время инкубации | 22 ч | |||
10.3 Метод отпечатков
10.3.1 Инкубация и приготовление посевного материала для испытаний
10.3.1.1 Инкубация А
Проводят отбор бактерий, находящихся в контейнере на хранении, используя бактериальную петлю. Культуру бактерий высевают штрихом на агар для подсчета (см. 6.11) ЕА и проводят инкубацию при температуре (37 ± 2) °С в течение 24-48 ч.
Примечание — Чашки хранят при температуре 5°С – 1 °С и используют не позднее чем через 1 неделю после приготовления.
Таблица 4 — Пример 2: Результаты испытаний (значение антибактериальной активности для метода переноса)
| Наименование бактерий для испытаний (номер штамма) |
Staphylococcus aureus (ATCC 6538) |
Klebsiella pneumoniae (ATCC 4352) |
||
| Концентрация посевного материала (моль/ л) | 3,2 ∙ 10-9 | 4,9 ∙ 10-9 | ||
| Разница экстремальных значений для трех контрольных полотен (lg) | 0 ч | 22 ч | 0 ч | 22 ч |
| 0,5 | 0,6 | 0,4 | 0,3 | |
| Значение роста F (F = lgCt – lgC0) |
+3,1 (lgCt: -9,1; lgC0: -12,2) |
+2,6 (lgCt: -9,4; lgC0: -12,0) |
||
| Значение роста G (G = lgTt – lgT0) |
-2,2 (lgTt: -14,5; lgT0: -12,3) |
-2,2 (lgTt: -14,1; lgT0: -11,9) |
||
| Значение антибактериальной активности (A = F – G) | 5,3 | 4,8 | ||
| Метод измерений | Метод люминесценции | |||
| Тип материала образцов |
Занавеска Полиэфир 100% |
|||
|
Тип нейтрализующего агента, добавленного по 6.10 Концентрация |
Лецитин яичного желтка 0,5% общего объема |
|||
| Метод стерилизации | γ-лучи | |||
| Время инкубации | 22 ч | |||
10.3.1.2 Инкубация В
В коническую колбу Эрленмейера объемом 100 мл наливают 20 мл питательного бульона (см. 6.5). Бактериальной петлей берут одну колонию с чашки с агаром ЕА (инкубация А), как описано в 10.3.1.1, и проводят посев в бульон. Инкубацию проводят в следующих условиях:
- температура: (37 ± 2) °С;
- степень встряхивания: 110 мин-1 с амплитудой 3 см;
- время инкубации: 18-24 ч.
10.3.1.3 Инкубация С
В коническую колбу Эрленмейера объемом 100 мл наливают 20 мл питательного бульона (6.5), в который затем вносят 0,4 мл из инкубации В, как описано в 10.3.1.2. Данная взвесь содержит от 1∙108 до 3∙108 КОЕ/мл или АТФ в концентрации от 1∙10-6 до 3∙10-6 моль/л.
Инкубацию осуществляют в следующих условиях;
- температура: (37 ± 2) °С;
- степень встряхивания: 110 мин-1 с амплитудой 3 см;
- время инкубации: (3 ± 1) ч.
Целью выращивания является получение количества КОЕ, равного 107 КОЕ/мл или концентрации АТФ, равной 10-7 моль/л после инкубации.
Примечание — Подготовленный материал для посева хранят на льду для охлаждения и используют в течение 8 ч.
10.3.1.4 Приготовление посевного материала для испытаний
Используя метод абсорбции, приготавливают бактериальную взвесь, содержащую от 1∙107 до 3∙107 КОЕ/мл, или методом люминесценции достигают концентрации АТФ, равной от 1∙10-7 до 3∙10-7 моль/л, используя 20-кратные разведения питательного бульона (см. 6.5) при комнатной температуре.
Примечание — Приготовленный материал для посева хранят на льду для охлаждения и используют в течение 4 ч.
10.3.2 Предварительная обработка образцов для испытаний
10.3.2.1 Подготовка образцов для испытаний
Берут шесть образцов контрольного полотна и шесть образцов с антибактериальной обработкой и с каждого образца вырезают куски площадью 60 мм2.
Если необходимо, то испытуемые образцы стирают по методу, изложенному в ИСО 6330, или другому соответствующему способу, и затем образцы ополаскивают водой для удаления моющих средств Использование других неспецифичных методов обработки должно быть отражено в протоколе испытаний
Примечание — Три контрольных образца и три образца с антибактериальной обработкой используют для подсчета числа бактерий сразу же после отпечатывания бактерий для испытаний. Оставшиеся образцы используют для подсчета числа бактерий после инкубации
10.3.2.2 Стерилизация образцов для испытания
Образцы помещают в чашки Петри (см. 5.17), которые накрывают алюминиевой фольгой, и стерилизуют в автоклаве при температуре 121°С и давлении 103 кПа в течение 15-20 мин. После стерилизации фольгу удаляют и размещают образцы на чистом лабораторном столе (см. 5.6) или в другом месте, исключающем риск контаминации образца воздухом, и сушат в течение 60 мин и более.
Если автоклавирование невозможно, то стерилизацию проводят газом этиленоксидом, гамма-лучами или другим подходящим методом. При этом использование альтернативных методов должно быть отражено в протоколе испытаний.
10.3.2.3 Регуляция влажности образцов для испытаний
10 мл агара наливают в чашку Петри (см. 5.17) для получения отпечатков (см. 6.12). Открытую чашку кладут на чистый лабораторный стол (см. 5.6) для охлаждения и затвердевания. Охлаждают до комнатной температуры, предотвращая образование конденсата. Когда агар затвердеет, переворачивают чашку вверх дном. Образец помещают внутри чашки и регулируют влажность образца в течение 18-24 ч.
10.3.3 Проведение испытания
10.3.3.1 Фильтрация бактерий
В фильтровальный аппарат, стерилизованный автоклавированием, помещают мембранный фильтр и устанавливают на лабораторном столе (см. 5.6).
Напивают 5 мл питательного бульона (см. 6.5), разведенного предварительно 20 раз, на мембранный фильтр и добавляют 2 мл посевного материала для испытаний, приготовленного в соответствии с 10.3.1.4. Проводят фильтрацию методом аспирации. Аспирацию (отсасывание) продолжают еще примерно в течение 1 мин. после того как исчезнет жидкость с мембранного фильтра.
Примечание 1 — Стерилизацию мембранного фильтра не проводят в связи с тем, что после его стерилизации изменяют размеры пор.
Примечание 2 — Шлаковое стекло или покрытую тефлоном сетку располагают под мембранным фильтром при использовании фильтровального аппарата. Для отсасывания используют маленький воздушный насос.
10.3.3.2 Отпечатывание тестовых бактерий
10.3.3.2.1 С помощью стерильного пинцета (см. 5.23) удаляют мембранный фильтр, на который были собраны тестовые бактерии, с фильтровального аппарата и помещают его на вращающийся столик аппарата для отпечатков (см. 5.10) стороной с бактериями сверху, как показано на рисунке 1.
10.3.3.2.2 Образец (см.10.3.2.3) извлекают из чашки Петри (см. 5.17), используя стерильный пинцет (см. 5.23), и кладут на мембранный фильтр лицевой стороной вниз.
10.3.3.2.3 На весовую плату помещают груз и отпечатывают бактерии с мембранного фильтра на образец, используя вращение столика на 180° в одном направлении в течение 3 с.
10.3.3.2.4 Немедленно после получения отпечатка образец переносят в чашку Петри, содержащую агар по 10.3.2.3. Образец с отпечатанной поверхностью располагают лицевой стороной вверх и помещают в термостат на 1-4 ч (см. 5.2).
10.3.3.3 Инкубационные испытания
Проводят инкубацию образца с отпечатками бактерий в чашке Петри по 10.3.3.2.4 в инкубаторе (см. 5.2) с кондиционированием при температуре (20 ± 2) °С и относительной влажности 70% и более в течение (1,0 ± 0,1) ч, (2,0 ± 0,1) ч, (3,0 ± 0,1) ч или (4,0 ± 0,1) ч. Время инкубации определяют исходя из специфики требований и условий испытаний. Время инкубации записывают в протоколе испытаний.
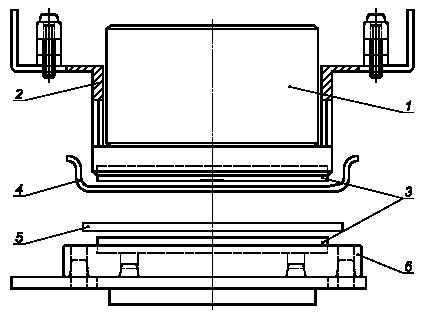
Примечание — Рисунок иллюстрирует проекцию (сторону) аппарата для получения отпечатков (см. 5.10). Внешние размеры (высота 170 мм, ширина 160 мм, глубина 150 мм).
1 — груз массой 17 кг; 2 — весовая плата; 3 — силиконовая резинка (диаметр 42 мм); 4 — образец (диаметр 60 мм); 5 — мембранный фильтр (диаметр 47 мм); 6 — вращающийся столик (диаметр 54 мм) (вращение против часовой стрелки).
Рисунок 1 —Аппарат для получения отпечатков[1]
10.3.3.4 Встряхивание после отпечатывания
Сразу же после получения отпечатков переносят каждый образец контрольного полотна по 10.3.3.2 в емкость, содержащую 20 мл среды SCDLP (см. 6.8), и встряхивают бактерии с каждого образца, как описано в разделе 9.
10.3.3.5 Встряхивание после инкубации
После инкубации переносят каждый образец по 10.3.3.3 в емкость, содержащую 20 мл среды SCDLP (см. 6.8), и встряхивают бактерии с каждого образца, как описано в разделе 9.
10.3.3.6 Расчет числа бактерий или количества АТФ
10.3.3.6.1 Основные положения
Получают число бактерий или количество АТФ по 10.3.3.4 и 10.3.3.5, исходя из концентрации бактерий или АТФ концентрации, полученных в соответствии с разделом 8 согласно формулам, приведенным в 10.3.3.6.2 и 10.3.3.3.6.3.
10.3.3.6.2 Число бактерий
М = CВ ∙ 20,
где М – число бактерий на образце;
СВ – концентрация бактерий, полученная по 8.1;
20 – объем встряхиваемого раствора, в миллилитрах (мл).
10.3.3.6.3 Количество АТФ
М' = CАТФ ∙ 20,
где М' — количество АТФ на образец;
САТФ – концентрация АТФ, полученная по 8.2;
20 – объем встряхиваемого раствора, в миллилитрах (мл).
[1] Данный аппарат доступен в Aloka Co., Ltd., 6-22-1, Mure. Mitaka-shi, Tokyo 181-8622, Japan. Данная информация приведена для удобства пользователей настоящим стандартом и не используется комитетом ИСО в качестве рекламы данного прибора.
10.3.4 Результаты испытаний
10.3.4.1 Оценка эффективности испытаний
Испытания можно признать эффективными при удовлетворении условий следующих двух перечислений. При невыполнении условий любого из этих перечислений испытания признают неэффективными и проводят повторные исследования.
a) Число бактерий для испытаний, отпечатанное на контрольном полотне, должно быть не менее чем 1,0∙106 КОЕ, а количество АТФ должно составлять не менее чем 1,0∙10-11 моль.
b) Показатель уменьшения или увеличения числа бактерий на контрольном образце F, полученный в соответствии с нижеследующей формулой, должен составлять от +0,5 до (-0,5).
F = lgСt – lgС0,
где F — уровень увеличения/уменьшения на контрольном полотне;
lgСt — среднее значение десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна после инкубации в течение 1-4 ч;
lgС0 — среднее значение десятичного логарифма от числа бактерий, или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна сразу же после получения отпечатков.
10.3.4.2 Вычисление уровня антибактериальной активности
Если испытание проведено эффективно, то уровень антибактериальной активности вычисляют по следующей формуле:
A = lgСt – lgTt,
где А — значение антибактериальной активности;
lgСt – значение среднего десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний контрольного полотна после инкубации в течение 1-4 ч;
lgTt – значение среднего десятичного логарифма от числа бактерий или среднее количество АТФ, полученное от трех образцов для испытаний полотен, прошедших антибактериальную обработку, после инкубации в течение 1-4 ч.
10.3.4.3 Протокол результатов испытаний
Протокол должен содержать наименования бактерий, используемых для испытаний, номер штамма, число перенесенных бактерий, уровень антибактериальной активности, метод измерения числа бактерий и тип образца (на примере таблиц 5 и 6).
Также записывают наименования и концентрации любых специальных нейтрализаторов, используемых для растворов при взбалтывании.
Таблица 5 — Пример 1: Результаты испытаний (значение антибактериальной активности, полученное методом печати)
| Наименование бактерий для испытаний (номер штамма) |
Staphylococcus aureus (ATCC 6538) |
Klebsiella pneumoniae (ATCC 4352) |
| Число бактерий на фильтре (КОЕ) | 3,0 ∙ 107 | 3,6 ∙ 107 |
| Число бактерий на контрольном полотне сразу же после отпечатывания (КОЕ) | 4,2 ∙ 106 | 6,4 ∙ 106 |
| Значение антибактериальной активности (A = lgCt – lgTt) |
1,7 (lgCt: +6,7; lgTt: +5,0) |
1,1 (lgCt: +6,7; lgTt: +5,6) |
| Метод измерений | Чашечный метод подсчета количества колоний на агаре | |
| Тип материала образцов |
Занавеска Полиэфир 100% |
|
| Метод стерилизации | Автоклав | |
| Время инкубации | 4ч | |
Таблица 6 – Пример 2: Результаты испытаний (значение антибактериальной активности, полученное методом печати)
| Наименование бактерий для испытаний (номер штамма) |
Staphylococcus aureus (ATCC 6538) |
Klebsiella pneumoniae (ATCC 4352) |
| Количество АТФ на фильтре (моль) | 2,9 ∙ 10-10 | 1,7 ∙ 10-10 |
| Количество АТФ на контрольном полотне сразу же после отпечатывания (моль) | 4,0 ∙ 10-11 | 3,0 ∙ 10-11 |
| Уровень антибактериальной активности (A = lgCt – lgTt) |
1,7 (lgCt: -10,4; lgTt: -12,1) |
1,1 (lgCt: -10,6; lgTt: -11,7) |
| Метол измерений | Люминесцентный метод | |
| Тип материала образцов |
Занавеска Полиэфир 100% |
|
| Метод стерилизации | Газ этиленоксид | |
| Время инкубации | 2ч | |
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов
национальным стандартам Российской Федерации
Таблица ДА 1
| Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
| ИСО 6330 | IDT | ГОСТ Р ИСО 6330-2009 «Материалы текстильные. Методы домашней стирки и сушки для испытаний» |
|
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT — идентичные стандарты. |
||
Библиография
| [1] | Guide to the expression of uncertainty in measurement (GUM), BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML, 19932) (Руководство по выявлению неопределенности в измерениях) |
| [2] ИСО 5725-1 | Точность (подлинность и достоверность) методов и результатов измерений. Часть 1. Основные принципы и определения |
| [3] ИСО 5725-2 | Точность (подлинность и достоверность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости стандартного метода измерений |
| [4] ИСО 5725-3 | Точность (подлинность и достоверность) методов и результатов измерений. Часть 3. Промежуточные вычисления точности стандартного метода измерений |
| [5] ИСО 5725-4 | Точность (подлинность и достоверность) методов и результатов измерений. Часть 4. Основные методы определения точности стандартного метода измерений |
| [6] ИСО 5725-6 | Точность (подлинность и достоверность) методов и результатов измерений. Часть 6. Применение на практике значений точности измерений |
| [7] ЕН 12353 | Химические дезинфектанты и антисептики. Предохранение организмов, используемых для испытаний бактерицидной, микобактерицидной спорицидной и фунгицидной активности |
УДК 677.04.001.4:006.354 ОКС 59.080.01 М09
07.100.99
Ключевые слова: метод, образцы, изделия текстильные, антибактериальная обработка, протокол исследований

