МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
межгосударственный стандарт
ГОСТ ISO 11930-2014
Продукция косметическая. Микробиология. Оценка антимикробной защиты косметической продукции
(ISO 11930:2012, IDT)
Издание официальное
Москва
Стандартинформ
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией «ПАРФЮМТЕСТ» (АНО «ПАРФЮМТЕСТ») на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 июня 2014 г. № 45-2014)
За принятие проголосовали:
| Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
| Армения | AM | Минэкономики Республики Армения |
| Беларусь | BY | Госстандарт Республики Беларусь |
| Киргизия | KG | Кыргызстандарт |
| Молдова | MD | Молдова-Стандарт |
| Россия | RU | Росстандарт |
| Таджикистан | TJ | Таджикстандарт |
| Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 10 сентября 2014 г. №1065-ст межгосударственный стандарт ГОСТ ISO 11930—2014 введен в действие в качестве национального стандарта Российской Федерации с 01 января 2016 г.
5 Настоящий стандарт идентичен международному стандарту ISO 11930:2012 Cosmetics - Microbiology - Evaluation of the antimicrobial protection of a cosmetic product (Косметика. Микробиология. Оценка антибактериальной защиты косметического средства).
Международный стандарт разработан Техническим комитетом по стандартизации ISO/TC217 «Косметика» Международной организации по стандартизации (ISO). Перевод с английского языка (en).
Официальный экземпляр международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT).
Наименование настоящего стандарта изменено относительно наименования международного стандарта в целях соблюдения принятой терминологии
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет.
Введение
Настоящий стандарт используют для общей оценки антимикробной защиты косметической продукции.
Существует несколько способов антимикробной защиты косметической продукции:
- химическое консервирование;
- характеристики, присущие продукции;
- конструкция упаковки;
- процесс производства.
В настоящем стандарте указана последовательность, в которой осуществляется оценка общей антимикробной защиты косметической продукции. Также в настоящем стандарте описан контрольный метод испытания на эффективность консервирования (Challengetest) наряду с критериями его оценки.
Для установления уровня антимикробной защиты, необходимого для минимизации потребительского риска, используют данные, полученные при оценке риска (см. ISO 29621) или испытании на эффективность консервирования.
ГОСТ ISO 11930—2014
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Продукция косметическая
МИКРОБИОЛОГИЯ
Оценка антимикробной защиты косметической продукции
Cosmetics. Microbiology. Evaluation of the antimicrobial protection of a cosmetic product
Дата введения - 2016-01-01
1 Область применения
1.1 Общая информация
Настоящий стандарт устанавливает:
- испытание на эффективность консервирования;
- процедуру оценки общей антимикробной защиты косметической продукции, которая согласно ISO 29621 не считается продукцией низкого риска.
В настоящем стандарте описана процедура интерпретации данных, полученных путем испытания на эффективность консервирования или оценки микробиологического риска, или того и другого.
1.2 Испытание на эффективность консервирования
Это испытание является контрольным методом, который используют для оценки консервирования косметической продукции. Его применяют для косметической продукции, находящейся на рынке.
Для косметической продукции с низким микробиологическим риском проведение этого испытания не требуется (см. Приложение А и ISO 29621).
Это испытание первоначально разработано для косметической продукции, которая растворяется в воде или смешивается с ней. Для продукции, в состав которой вода входит в виде дисперсной фазы, может потребоваться адаптировать это испытание. Испытание, описанное в настоящем стандарте, подразумевает для каждого тест-микроорганизма помещение продукта в среду с калиброванной культурой, а затем измерение изменений в количестве микроорганизмов через определенные временные интервалы в течение определенного временного периода при определенной температуре.
Примечание – На основе этого контрольного метода можно разрабатывать собственные методы в ходе цикла разработки косметической продукции. В подобном случае допускается изменение и расширение метода, чтобы учесть уже накопленные данные и различные факторы, такие как штаммы бактерий, среду, условия созревания, длительность воздействия, и т.п. Критерии соответствия можно адаптировать под конкретные цели. Во время цикла разработки косметической продукции по мере необходимости можно использовать и другие методы для определения на эффективность консервирования продукции.
1.3 Процедура оценки антимикробной защиты косметической продукции
Эта процедура основана на тщательном рассмотрении следующих моментов:
- результаты испытания на эффективность консервирования. Испытание на эффективность консервирования требуется не для всех косметических продуктов (см. приложение А и ISO 29621);
- характеристики продуктов и данные, полученные при оценке микробиологического риска (см. ISO 29621). Анализ оценки микробиологического риска основан на комплексном подходе. В частности, он сочетает в себе такие факторы как: характеристики состава продукта, условия производства, характеристики упаковки, в которой продукт будет доставляться на рынок, рекомендации по использованию косметической продукции и, при необходимости, область применения и целевую аудиторию (см. приложение D).
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных ссыпок применяют последнее издание ссылочного стандарта (включая его изменения).
ISO 16212, Cosmetics - Microbiology - Enumeration of yeast and mould (Косметика. Микробиология Подсчет количества дрожжей и плесени)
ISO 18415. Cosmetics - Microbiology - Detection of specified and non-specified microorganisms (Косметика. Микробиология. Выявление специфических и неспецифических микроорганизмов)
ISO 21148, Cosmetics - Microbiology - General instructions for microbiological examination (Продукция косметическая. Микробиология. Общие указания по микробиологическому контролю)
ISO 21149. Cosmetics - Microbiology - Enumeration and detection of aerobic mesophilic bacteria (Продукция косметическая. Микробиология. Подсчет и обнаружение аэробных мезофильных бактерий)
ISO 22716. Cosmetics - Good Manufacturing Practices (GMP) - Guidelines on Good Manufacturing Practices [Продукция косметическая. Надлежащая практика организации производства (GMP). Руководящие указания по надлежащей практике организации производства]
ISO 29621. Cosmetics - Microbiology - Guidelines for the risk assessment and identification of microbiologically low-risk products (Продукция косметическая. Микробиология. Руководящие указания по оценке риска и идентификации продукции с микробиологически низким риском)
Примечание – При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользовании — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ISO 21148, а также следующие термины с соответствующими определениями:
3.1 масса (состав) косметического продукта (cosmetic formulation): Смесь сырья с количественно и качественно определенным составом.
3.2 косметическая продукция (cosmeticproduct): Готовая косметическая продукция, которая прошла все этапы производства, включая упаковку в контейнер для отгрузки.
3.3 антимикробная защита косметической продукции (antimicrobial protection of a cosmetic product): Способность косметической продукции преодолевать микробное загрязнение, которое может представлять потенциальный риск для потребителя.
Примечание – Полная антимикробная защита включает консервирование, особенности производственного процесса и защитную упаковку.
3.4 консервирование массы косметического продукта (preservation of a cosmetic formulation): Набор средств, которые используют во избежание размножения микроорганизмов в косметическом продукте.
Пример - Консерванты, многофункциональные соединения, агрессивное сырье, крайние уровни рН, низкое значение активности воды.
3.5 контрольный метод (reference method): Метод, который применяют заинтересованные стороны для оценки продукта на рынке или в случае разногласий.
3.6 разработанный метод, «собственный метод» (developmentmethod, «in-housemethod»): Метод, который используют на этапе разработки продукта до его выхода на рынок.
3.7 потребитель (consumer): Конечный пользователь косметической продукции.
4 Сущность метода
В оценку антимикробной защиты косметической продукции входят следующие элементы (см. приложение А).
а) Характеристики ее состава (см. ISO 29621) или результаты испытания на эффективность консервирования (если оно проводилось), или и то и другое.
Испытание на эффективность консервирования описано в 5.1.
b) Характеристики косметической продукции в сочетании с условиями производства (см. ISO 22716 и ISO 29621), упаковочные материалы и, если на то есть основания, рекомендации по использованию продукции (см. ISO 29621).
В настоящем стандарте описана процедура интерпретации данных, полученных путем испытания на эффективность консервирования (если это уместно) или оценки микробиологического риска.
5 Испытание на эффективность консервирования
5.1 Общая информация
Оценку консервирования массы косметического продукта выполняют путем внесения в нее калиброванной культуры, подготовленной из соответствующих штаммов микроорганизмов. Количество выживших клеток микроорганизмов измеряют с определенными интервалами в течение 28 дней. Логарифмический показатель снижения количества клеток микроорганизмов для каждого периода времени и каждого штамма высчитывают и сравнивают с необходимыми минимальными значениями для критериев оценки А или В (см. приложение В).
При использовании контрольного метода отклонения от установленных процедур не допускаются, так как это может привести к получению недостоверных результатов. В ходе разработки продукта допускается использовать другие подходящие собственные разработанные методы для определения на эффективность консервирования продукции (см. 1.2).
До проведения испытания необходимо определить микробиологические качества продукции согласно ISO 21149 и ISO 16212, или ISO 18415.
Примечание - Микроорганизмы, изначально присутствующие в пробе для испытания, не должны мешать выделению микроорганизмов, применяемых в опыте.
Во время испытания необходимо проверять и показывать нейтрализацию возможной антимикробной активности пробы для испытания (см. 5.5).
5.2 Материалы, оборудование, реактивы и питательные среды
В ISO 21148 указаны общие технические характеристики и инструкции. Если в составе используется вода, то нужно использовать дистиллированную или очищенную воду, как указано ISO 21148 (пункт 8.2).
5.2.1 Материалы
Используют стандартное оборудование микробиологической лаборатории (см. ISO 21148) и:
5.2.1.1. Стеклянные шарики диаметром от 3 до 4 мм.
5.2.1.2 Фильтр из пористого стекла с пористостью 2 (от 40 мкм до 100 мкм)
5.2.1.3 Колбы.
5.2.1.4 Стерильную стеклянную посуду подходящей вместимости с крышками
5.2.1.5 Центрифугу с центробежной силой 2000 g.
5.2.2 Разбавители, нейтрализаторы и питательная среда
5.2.2.1 Общая информация
Если не указано иное, перед использованием все реактивы необходимо довести до температуры окружающей среды. При наличии можно использовать готовые к употреблению реактивы и среду.
5.2.2.2 Разбавитель
5.2.2.2.1 Состав
Панкреатический гидролизат казеина – 1,0 г.
Хлорид натрия – 8,5 г.
Вода - 1000 см3.
5.2.2.2.2 Подготовка
Растворяют компоненты в воде, помешивая во время нагревания. Разливают в подходящую посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин После стерилизации уровень рН должен составить (7,0 ± 0,2) при измерении его при комнатной температуре.
5.2.2.2.3 Раствор полисорбата 80 (для подготовки взвеси спор A. brasiliensis)
Готовят раствор полисорбата 80 [0,5 г/дм3]. Нагревают, помешивая, до полного растворения. Разливают раствор в подходящую посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
5.2.2.3 Нейтрализатор
5.2.2.3.1 Общая информация
Необходимо продемонстрировать пригодность и эффективность нейтрализующего агента по отношению к испытуемым штаммам и испытуемому продукту так, как это указано в 5.5.
Чаще всего применяют нейтрализатор, описанный в 5.2.2.3.2. Примеры других подходящих нейтрализаторов приведены в приложении С.
5.2.2.3.2 Питательная среда Eugon LT 100
5.2.2.3.2.1 Общая информация
Эта среда содержит ингредиенты, которые нейтрализуют ингибиторы в пробе (лецитин и полисорбат 80), а также диспергирующий агент октоксинол 9 (например, Triton Х100®[1]). Ее можно приготовить согласно 5.2.2.3.2.2 или из сухой питательной среды, согласно инструкциям производителя. Также можно использовать готовую среду.
5.2.2.3.2.2 Состав
Панкреатический гидролизат казеина - 15 г.
Папаиновый гидролизат сои - 5 г.
Хлорид натрия - 4 г.
L-цистеин – 0,7 г
Сульфит натрия - 0,2 г.
Глюкоза - 5,5 г.
Яичный лецитин - 1 г.
Полисорбат 80 - 5 г.
Октоксинол 9 - 1 г.
Вода - 1000 см3.
5.2.2.3.2.3 Подготовка
Последовательно растворяют в кипящей воде полисорбат 80, октоксинол 9 и яичный лецитин до полного растворения. Растворяют другие компоненты, помешивая во время нагревания. Разливают раствор в подходящую посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. Хорошо перемешивают после стерилизации, пока жидкость еще достаточно горячая, чтобы растворить выпавший осадок. После стерилизации уровень pH должен составить (7,0 ± 0,2) при измерении его при комнатной температуре.
5.2.2.4 Питательные среды
5.2.2.4.1 Общая информация
Питательную среду можно приготовить согласно 5.2.2.4.2 или из сухой питательной среды, согласно инструкциям производителя. Допускается использование готовой среды, если ее состав и/или ростовые качества близки к составу, указанному в 5.2.2.4.2.1.
5.2.2.4.2 Питательная среда для бактерий: триптон-соевый агар (TSA) или агаризованная среда с соевым и казеиновым гидролизатами
5.2.2.4.2.1 Состав
Панкреатический гидролизат казеина - 15 г.
Папаиновый гидролизат сои - 5 г.
Хлорид натрия - 5,0 г.
Агар-агар - 15,0 г.
Вода - 1000 см3.
5.2.2.4.2.2 Подготовка
Растворяют компоненты или готовую сухую смесь питательной среды в воде, помешивая во время нагревания. Разливают раствор в подходящую посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. Хорошо перемешивают после стерилизации, пока жидкость еще достаточно горячая, чтобы растворить выпавший осадок. После стерилизации и охлаждения уровень pH должен составить (7,3 ± 0,2) при измерении его при комнатной температуре.
5.2.2.4.3 Питательная среда для С. albicans: декстрозный агар Сабуро (SDA)
5.2.2.4.3.1 Состав
Декстроза - 40,0 г.
Пептоны – 5,0 г.
Панкреатический гидролизат казеина - 5,0 г.
Агар-агар – 15,0 г.
Вода - 1000 см3.
5.2.2.4.3.2 Подготовка
Растворяют компоненты или готовую сухую смесь питательной среды в воде, помешивая во время нагревания. Разливают раствор в подходящую посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации уровень рН должен составить (5,6 ± 0,2) при измерении его при комнатной температуре.
5.2.2.4.4 Питательная среда для A. brasiliensis: картофельный агар с декстрозой (PDA)
5.2.2.4.4.1 Состав
Картофельный настой (см. 5.2.2.4.4.2, Примечание 1) – 200,0 г.
Декстроза – 20,0 г.
Агар-агар (см. 5.2.2.4.4.2, Примечание 2) - 20,0 г.
Вода - 1000 см3.
5.2.2.4.4.2 Подготовка
Растворяют компоненты или готовую сухую смесь питательной среды в воде, нагревая ее. Разливают раствор в подходящую посуду. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. После стерилизации уровень рН должен составить (5,6 ± 0,2) при измерении его при комнатной температуре.
Примечание 1 – Чтобы приготовить картофельный настой, можно воспользоваться сухим порошком, который есть в продаже, или прокипятить 200 г нарезанного, нечищеного картофеля в 1 дм3 воды в течение 30 мин. Фильтруют с помощью марли, сохраняя жидкость.
Примечание 2 — Приобретенные сухие смеси, содержащие менее 20 г/дм3 агар-агара, можно довести до необходимой концентрации, дополнительно добавив необходимое количество агар-агара.
[1] Triton Х100® — пример доступного для приобретения продукта. Данная информация приведена для удобства пользователей настоящего стандарта и не означает одобрение данного продукта организацией ISO.
5.3 Штаммы микроорганизмов
Испытание проводят, используя следующие штаммы в качестве экспериментальных микроорганизмов:
- Pseudomonas aeruginosa АТСС®9027™[1], равноценные штаммы: СIР®82.118™[2], или NCIMB®8626™[3], или NBRC®13275™[4], или КСТС®2513™[5], или другие равноценные местные коллекционные штаммы;
- Staphylococcus aureus АТСС®6538™, равноценные штаммы: CIP®4/83™, или NCIMB®9518™, или NBRC®13276™, или КСТС®3881™, или NCTC®10788™[6], или другие равноценные местные коллекционные штаммы;
- Escherichia coli АТСС®8739™, равноценные штаммы: CIP®53.126™, или NCIMB®8545™, или NBRC®39721™, или КСТС®2571™, или NCTC®12923™, или другие равноценные местные коллекционные штаммы;
- Candida albicans АТСС®10231™, равноценные штаммы: IP 48.72™[7] или NCPF® 3179™[8], или NBRC®1594™, или КСТС®7965™, или другие равноценные местные коллекционные штаммы;
- Aspergillus brassiliensis (устаревшее название А. niger) АТСС®16404™, равноценные штаммы: IP 1431, или IMI®149007[9], или NBRC®9455™, или КСТС®6196™, или другие равноценные местные коллекционные штаммы.
Культура должна быть восстановлена в соответствии с процедурами, предусмотренными поставщиком референс штамма. Штаммы хранят в лаборатории согласно EN 12353 или в соответствии с другим подходящим методом.
[1] АТСС®: Американская коллекция типовых культур.
[2] СIР®: Коллекция Института Пастера.
[3] NCIM®: Национальная коллекция промышленных морских бактерий.
[4] NBRC®: Центр биологических ресурсов NITE, Япония.
[5] КСТС®: Корейская коллекция типовых культур.
[6] NCTC®: Национальная коллекция типовых культур.
[7] IP: Институт Пастера.
[8] NCPF®: Национальная коллекция патогенных грибов.
[9] IMI: Международный микологический институт. Великобритания.
5.4 Подготовка и учет калиброванных культур
5.4.1 Общая информация
Для проведения испытаний выполняют пересев штаммов, которые хранят в лаборатории (см. 5.3), чтобы получить исходные культуры и рабочие культуры.
Исходная культура - это конфлюэнтная культура, полученная путем посева культуры из хранилища штрихом на пробирки со скошенным агаром или на чашки Петри с помощью одноразового шарика. После инкубации исходная культура может храниться при температуре от 2°С до 8°С до двух месяцев и применяться для получения рабочих культур.
Из рабочей культуры, которую готовят непосредственно перед экспериментом, получают калиброванную суспензию (инокулят).
Исходную и рабочую культуры выращивают в одинаковых условиях инкубирования на одинаковой питательной среде (см. 5.4.2 и 5.4.3).
Примечание 1 – Ограничение количества последовательных пересевов и использование конфлюэнтных культур, а не изолированных колоний, снижает риск изменения восприимчивости штаммов. Стандартизация условий созревания и подготовки инокулята повышает воспроизводимость метода.
Примечание 2 - Использование многоразовой посуды, которую хранят в замороженном виде, может привести к изменению восприимчивости штаммов, вызванному действием тепловых ударов. Это может произойти, если посуду вынимают из морозильного шкафа, из нее извлекают один шарик, а затем посуду возвращают в шкаф.
5.4.2 Подготовка суспензий бактерий и Candida albicans
5.4.2.1 Для подготовки рабочей культуры испытуемого микроорганизма необходимо подготовить субкультуру путем посева исходной культуры штрихом на пробирки со скошенным агаром или на чашки Петри (TSA для бактерий. SDA для C. albicans), чтобы получить конфлюэнтную культуру. Выращивают при температуре (32,5 ± 2,5) °С в течение 18-24 ч.
Таким же образом готовят вторую субкультуру путем посева первой культуры и выращивают при температуре (32,5 ± 2,5) °С в течение 18-24 ч. Третью субкультуру можно вырастить таким же способом путем посева второй культуры. Вторая культура и третья (если она была выращена) образуют рабочую культуру.
Если нельзя получить вторую субкультуру своевременно, тогда допускается выдерживать первую культуру до 48 ч в инкубаторе при температуре (32,5 ± 2,5) °С, а затем использовать ее для подготовки второй субкультуры. В этом случае готовят третью субкультуру в течение 18-24 ч и используют ее в испытании.
Не рекомендуется готовить четвертую субкультуру из исходной культуры.
5.4.2.2 Берут 10 см3 разбавителя (см 5.2.2.2) и помещают в подходящую стерильную посуду со стерильными стеклянными шариками массой около 5 г. Переносят клетки, выращенные в агаризованной среде, в разбавитель с помощью петель для посева. Клетки суспендируют в разбавителе, потерев петлю с небольшим количеством разбавителя о стенку посуды, чтобы отделить клетки.
5.4.2.3 Гомогенизируют суспензию, встряхивая посуду вручную или механическим способом в течение 3 мин. Отбирают верхнюю часть суспензии с помощью аспиратора (избегая контакта со стеклянными шариками) и переносят полученную суспензию в стерильную посуду.
5.4.2.4 Регулируют концентрацию клеток в суспензии с помощью растворителя (см. 5.2.2.2) согласно данным о калибровке, полученным в лаборатории (например, с помощью спектрофотометра, см. ISO 21148, приложение С). Концентрация должна составлять от 1 х 107 КОЕ/см3 до 1 х 108 КОЕ/см3 для бактерий и от 1 х 106 КОЕ/см3 до 1 х 107 КОЕ/см3 для С.
Калиброванный раствор используют в течение двух часов.
5.4.2.5 При выполнении эксперимента проверяют исходную концентрацию клеток в суспензии, N. Выполняют серию десятикратных разведений калиброванной суспензии с помощью растворителя (см. 5.2.2.2). Выполняют подсчет количества клеток путем переноса 1 см3 подходящих растворов (см. 5.6.2) в среду TSA для бактерий и SDA для C. albicans. Выращивают при температуре (32,5 ± 2,5) °С в течение 24-48 ч.
5.4.3 Подготовка взвеси спор A. brasiliensis (устаревшее название A. niger)
5.4.3.1 Для получения рабочей культуры тест-микроорганизма готовят суспензию клеток исходной культуры (на PDA) не старше двух месяцев в растворителе (см. 5.2.2.2). Выполняют посев, залив суспензию на поверхность среды PDA, помещенной в колбу или подходящее количество чашек Петри, чтобы получить конфлюэнтную культуру. Выращивают при температуре (22,5 ± 2,5) °С в течение 7-11 дней.
5.4.3.2 После выращивания переносят 10 см3 раствора полисорбата 80 (см. 5.2.2.2.3) в колбу. Осторожно отделяют споры от поверхности культуры, используя лопатку или стеклянные шарики.
Переносят суспензию в подходящую колбу и осторожно перемешивают со стеклянными шариками в течение примерно 1 мин. Фильтруют суспензию с помощью фильтра из пористого стекла с пористостью 2 (от 40 до 100 мкм).
5.4.3.3 Выполняют микроскопирование (увеличение х400), чтобы установить наличие проросших спор или фрагментов мицелия.
- Если присутствуют проросшие споры, раствор считают непригодным для эксперимента.
- Если мицелий обнаружен более чем в одном поле зрения из десяти, необходимо промыть отфильтрованную суспензию путем ресуспендирования ее в растворе полисорбата 80 (см. 5.2.2.2.3) с дальнейшим центрифугированием в течение 20 мин при 2000 g. Данную процедуру повторяют, по крайней мере, два раза.
5.4.3.4 Доводят концентрацию спор в суспензии до количества в пределах от 1 х 106 спор/см3 до 1 х 107 спор/см3 с помощью растворителя (см. 5.2.2.2) или другим подходящим способом
Примечание - Для регулирования концентрации спор рекомендуется использовать прибор для подсчета клеток (например, гемоцитометр). Если используют счетную камеру, работу с ней осуществляют согласно инструкциям
Суспензию используют в день приготовления. Допускается использовать суспензию и на следующий день, если она хранилась при температуре от 2 °С до 8 °С, но при этом следует повторно выполнить проверку на наличие проросших спор.
5.4.3.5 При выполнении эксперимента проверяют исходную концентрацию клеток в суспензии N. Выполняют серию десятикратных разведений калиброванной суспензии с помощью растворителя (см 5.2.2.2). Выполняют подсчет количества спор путем переноса 1 см3 подходящих растворов (см. 5.6.2) на чашки Петри средой PDA, используя их подходящее количество. Выращивают при температуре (22,5 ± 2,5) °С в течение трех-пяти дней.
5.5 Демонстрация эффективности нейтрализатора
5.5.1 Принцип
Выполняют проверку способности нейтрализатора в присутствии каждого микроорганизма нейтрализовать антимикробное действие тестируемого состава, не вызывая ингибирование роста тест-микроорганизмов.
Калиброванную суспензию клеток микроорганизмов (примерно 103 КОЕ/см3) вводят в состав нейтрализатора с добавлением массы продукта (экспериментальный образец) и без добавления массы продукта (контрольный образец). Нейтрализатор считается эффективным, если количество клеток микроорганизмов в инокуляте Nv и в контрольном образце Nvn (смеси нейтрализатора и растворителя) эквивалентно, а количество микроорганизмов в составе Nvt (смеси нейтрализатора и продукта) составляет не менее 50% Nvn (см. 5.5.4).
5.5.2 Процедура
Проводят эксперимент отдельно для каждого штамма
a) Готовят раствор калиброванной суспензии клеток микроорганизмов [N от 1 х 107 КОЕ/см3 до 1 х 108 КОЕ/см3 для бактерий, и от 1 х 106 КОЕ/см3 до 1 х 107 КОЕ/см3 для С. albicans и A. brasiliensis (см. 5.4.2 и 5.4.3)], содержащий примерно 103 КОЕ/см3 (инокулят).
b) Помещают 1 г или 1 см3 испытуемого продукта в 9 см3 нейтрализатора (см. 5.2.2.3). Перемешивают продукт путем встряхивания. При необходимости (т. е., если нейтрализатор окажется неэффективным), выполняют очередное десятикратное разведение в нейтрализаторе.
Прочие условия эксперимента не нормируют. Единственным требованием является наличие не менее 1 г или 1 см3 продукта, а также выполнение хотя бы одного десятикратного разведения.
c) Оставляют пробирки с экспериментальным образцом в течение (30 ± 15) мин при комнатной температуре. Выполняют контрольное испытание, используя тот же нейтрализатор, заменив испытуемый состав 1 см3 растворителя (см. 5.2.2.2).
d) В пробирку с экспериментальным образцом [содержащую десятикратно разведенный состав, а если потребуется, то и более, см. 5.5.2 b)] и пробирку с контрольным образцом помещают по 1 см3 инокулята [см. 5.5.2 а)]. Окончательный объем должен составить 11 см3. Перемешивают.
e) Готовят контрольный инокулят. Добавляют 1 см3 инокулята [5.5.2 а)] к 10 см3 растворителя. Окончательный объем должен составить 11 см3. Перемешивают.
f) В двух повторностях подсчитывают количество микроорганизмов в экспериментальном образце, контрольном образце и контрольном инокуляте, после культивирования в соответствующей питательной среде (TSA для бактерий, SDA для С. albicans и PDA для A. brasiliensis)
Примечание – Рекомендуется применять калиброванную суспензию объемом 1 см3, так как это повышает точность счета количества микроорганизмов в смесях.
g) Бактерии и С. albicans выращивают при температуре (32,5 ± 2,5) °С в течение 48-72 ч. A. brasiliensis выращивают при температуре (22,5 ± 2,5) °С в течение трех-пяти дней.
5.5.3 Расчеты
Получают Nv количество микроорганизмов, присутствующих в контрольном инокуляте [см. 5.5.2 e)] в КОЕ/см3.
N - среднее количество колоний, подсчитанных на двух чашках Петри, содержащиеся в 1 см3 контрольного инокулята;
Ожидаемое значение Nv - около 100.
Получают Nvt количество микроорганизмов, присутствующих в экспериментальном образце, состоящем из нейтрализатора и массы продукта, а также Nvn количество микроорганизмов в контрольном образце, не содержащем массы продукта. Показатели выражают в колониеобразующих единицах на кубический сантиметр.
Nvt и Nvn – это среднее количество колоний, подсчитанное в 1 см3, соответственно, экспериментальных и контрольных образцов, на чашках Петри с соответствующей питательной средой.
5.5.4 Интерпретация результатов и получение вывода об эффективности нейтрализатора
Нейтрализатор считают эффективным, если Nvt ≥ 0,5 Nvn, а Nvn мало отличается от Nv. Если Nvn значительно отличается от Nv, то нейтрализатор считают токсичным по отношению к микроорганизмам.
Следует принимать во внимание разброс результатов, полученных при подсчете количества колоний микроорганизмов, выросших на чашках Петри с соответствующей питательной средой. Два показателя обычно считают отличными друг от друга, если разница между ними превышает 50%.
Следует зафиксировать условия испытания (нейтрализатор, объемы и т.п.), а в особенности степень разведения продукта (1/10, 1/100 или другую), при которой показана эффективность нейтрализатора.
Если результаты не соответствуют требованиям, выполняют следующее:
- либо меняют нейтрализатор (см. приложение С) или выполняют разведение пробы,
- либо выполняют фильтрование с помощью мембраны, если это возможно.
Если и в таком случае результаты не соответствуют требованиям, маловероятно, что продукт может быть заражен испытуемым штаммом. Даже в таком случае, если это возможно, следует составить отчет об испытании [см. 5.7 и 5.8 f)].
5.6 Определение на эффективность консервирования массы продукта
5.6.1 Процедура
Выполняют эксперимент отдельно для каждого штамма.
5.6.1.1 Вскрытие испытуемого продукта и отбор его отдельных порций
Для каждого штамма помещают 20 г или 20 см3 испытуемого продукта в стерильную посуду (5.2.1.4).
5.6.1.2 Посев тест-микроорганизмов
В каждую единицу посуды добавляют 0,2 см3 калиброванного инокулята (см. 5.4.2 и 5.4.3), чтобы получить конечные концентрации клеток в продукте: от 1 х 105 КОЕ/см3 до 1 х 106 КОЕ/см3 или г бактерий, и от 1 х 104 КОЕ/см3 до 1 х 105 КОЕ/см3 или г C. albicans и A. brasiliensis. Тщательно перемешивают, чтобы равномерно распределить инокулят.
Начальную концентрацию клеток микроорганизмов, присутствующих в инокулированном продукте, N01, определяют по результатам подсчета количества клеток микроорганизмов в калиброванном инокуляте N [см. 5.6.3.2 b)].
5.6.1.3 Экспозиция инокулированного продукта
Посуду с инокулированным продуктом хранят при температуре (22,5 ± 2,5) °С.
5.6.1.4 Отбор проб и подсчет количества микроорганизмов
а) С интервалом в семь дней (Т7), 14 дней (Т14) или 28 дней (Т28) (в зависимости от испытуемого штамма, как описано в Приложении В), отбирают 1 г или 1 см3 инокулированного продукта.
Взятые пробы объемом 1 г или 1 см3 помещают в 9 см3 нейтрализатора (см. 5.2.2.3). Смешивают до получения однородности.
Если эффективность нейтрализатора установлена при разведении 1/100 [см. 5.5.2 b)], выполняют еще одно десятикратное разведение в нейтрализаторе.
Примечание — При выполнении второго разведения допускается использование разведения другой кратности, если при такой кратности установлена эффективность нейтрализатора (см. 5.5.4), и она учтена при расчете Nх (см.5.6.3.3).
Выдерживают пробу в течение (30 ±15) мин при комнатной температуре.
b) Начиная от разведения в нейтрализаторе 1/10 (или от 1/100, или другой кратности, если эффективность нейтрализатора установлена для разведения 1/100 или для другой кратности), выполняют серию последовательных десятикратных разведений в нейтрализаторе (см. 5.2.2.2), чтобы выполнить подсчет количества клеток выживших микроорганизмов.
c) Через семь дней следует выполнить подсчет клеток микроорганизмов во всех полученных разведениях в нейтрализаторе (1/10, а затем 1/100, или другом). Через 14 и 28 дней допускается уменьшить количество разведений, в которых выполняется подсчет клеток микроорганизмов, исходя из результатов измерения через семь дней.
d) Выполняют подсчет количества клеток микроорганизмов с помощью подходящей питательной среды (TSA для бактерий, SDA для и PDA для iПодсчет количества клеток проводят из двух параллельных высевов.
В чашки Петри диаметром от 85 до 100 мм вносят 1 см3 из каждого разведения, и заливают 15-20 см3 расплавленной питательной среды, выдерживаемой на водяной бане при температуре не болев 48°С. Осторожно перемешивают содержимое, поворачивая и наклоняя чашки Петри для равномерного распределения микроорганизмов. Дают застыть на горизонтальной поверхности при комнатной температуре.
Допускается применение других методов подсчета количества микроорганизмов (поверхностный посев и фильтрация мембраной). Их применение требует адаптации метода с учетом параметров, указанных выше.
Для подсчета рекомендуется использовать 1 см3 смеси, так как это повышает точность.
e) Бактерии и С. albicans выращивают при температуре (32,5 ± 2,5) °С в течение 48-72 ч. A. brasiliensis выращивают при температуре (22,5 ± 2,5) °С в течение трех-пяти дней.
5.6.2 Подсчет колоний
После выращивания оценивают количество колоний в чашках. При всех подсчетах (см. 5.4.2.5, 5.4.3.5 и 5.6.1.4 с)] учитывают чашки, в которых обнаружено от 30 до 300 колоний бактерий и С. albicans и от 15 до 150 колоний A. brasiliensis.
Когда количество колоний выживших клеток микроорганизмов, полученных, как описано в 5.6.1.4 с) перестанет входить в эти пределы [количество более 300 (150 для A. brasiliensis) или менее 30 (15 для A brasiliensis)], фиксируют результат как > 300 (>150 для A. brasiliensis) или < 30 (< 15 для A. brasiliensis).
Определяют количество жизнеспособных клеток микроорганизмов, присутствующих в пробе на момент времени to (N0 = N/100) в соответствии с 5.6.3.2, и количество выживших клеток микроорганизмов при взятии каждой пробы, Nх, в соответствии с 5.6.3.3.
5.6.3 Расчеты
5.6.3.1 Общие положения
Эффективность нейтрализатора должна быть проверена согласно 5.5.4, а экспериментальные данные должны соответствовать правилам, приведенным в 5.6.2.
5.6.3.2 Определение начального количества микроорганизмов N и N0
a) Получают N количество клеток микроорганизмов в калиброванных суспензиях (см. 5.4.2 и 5.4.3) в КОЕ/см3 по формуле (1)
N = C(V ∙ d), (1)
где C - среднее количество колоний (см. 5.6.2), подсчитанных на двух параллельных чашках Петри;
V – объем инокулята, помещенного в каждую чашку (1 см3, в соответствии с 5.4.2 и 5.4.3), см3;
d - кратность разведения испытуемого раствора.
Для бактерий N должно быть в пределах от 1 х 107 КОЕ/см3 до 1 х 108 КОЕ/см3, а для С. albicans и A. brasiliensis - от 1 х 106 КОЕ/см3 до 1 х 107 КОЕ/см3.
b) Определяют N0 количество клеток микроорганизмов, внесенных в продукт в момент времени to по формуле (2)
N0 = N/100. (2)
Для бактерий N0 должно быть в пределах от 1 х 105 КОЕ/см3 и 1 х 106 КОЕ/см3 или г, а для С. albicans и A. brasiliensis от 1 х 104 КОЕ/см3 до 1 х 105 КОЕ/см3 или г.
5.6.3.3 Подсчет количества клеток микроорганизмов в каждый момент взятия порций (аликвот) образца, Nх
Определяют Nх количество микроорганизмов, в КОЕ/см3 или г, в продукте в каждый момент взятия образца tх (Т7, Т14 или Т28), по формуле (3)
Nх = C / (V ∙ d), (3)
где С - среднее количество колоний (см. 5.6.2), подсчитанных на двух параллельных чашках Петри;
V- объем инокулята, помещенного в каждую чашку [1 см3 в соответствии с 5.6.1.4 а)], см3;
d - кратность разведения, соответствующая сохраненному и подсчитанному разведению [см. 5.6.1.4 с) с учетом второго десятикратного разведения в нейтрализаторе согласно 5.6.1.4 а)].
5.6.3.4 Снижение количества клеток микроорганизмов
Считают показатели снижения, Rx, выраженные в логарифмических единицах, в каждый момент взятия образца по формуле (4)
Rx = logN0 – logNx, (4)
где N0 – количество клеток микроорганизмов, внесенных в момент времени t0 [см. 5.6.3.2 b)];
Nx – количество жизнеспособных микроорганизмов через определенные промежутки времени tx, (см. 5.6.3.3).
Снижение может отсутствовать. Также может наблюдаться увеличение количества микроорганизмов.
5.7 Интерпретация результатов эксперимента и получение выводов
5.7.1 Критерии
Полученные логарифмические показатели снижения количества бактерий, Rх (см. 5.6.3.4), сравнивают с минимальными значениями, соответствующими критериям оценки А и В, приведенным в Приложении В.
Критерии, представляющие защитные свойства состава косметических продуктов, включают в себя:
- критерий А, согласно которому продукт защищен от размножения микроорганизмов, которые потенциально могут угрожать пользователю, без учета дополнительных факторов [см. 6.2 а)];
- критерий В, согласно которому уровень защиты считается приемлемым, если анализ рисков показывает наличие факторов контроля, не связанных с продуктом, которые обеспечивают удовлетворительный уровень микробиологического риска косметического продукта [см. 6.2 b)].
Критерии выражают либо в виде минимального логарифмического показателя снижения количества микроорганизмов, либо в виде отметки «NI», которая означает, что требуется хотя бы отсутствие роста количества микроорганизмов.
Естественный разброс результатов, полученных при подсчете количества клеток микроорганизмов при определении показателей Rх, принимают во внимание при сопоставлении значений Rх с критериями А и В. В настоящем стандарте отклонение 0,5 логарифмических единиц от установленного критерия считается допустимым.
5.7.2 Общий случай (эффективность нейтрализатора показана для всех штаммов)
Для каждого из микроорганизмов выполняют сопоставление значений Rх с критериями А и В (Приложение В и 5.7).
a) Если все показатели снижения удовлетворяют критерию А, считают, что состав соответствует требованиям класса А настоящего теста по оценке консервирования, и, согласно 6.2 а), соответствует требованиям настоящего стандарта.
b) Если все показатели снижения удовлетворяют только критерию В, состав считают соответствующим требованиям класса В настоящего испытания по оценке консервирования. Следует предоставить дополнительные основания того, что продукт соответствует требованиям настоящего стандарта [см. 6.2 b)].
c) Если один или более показателей снижения не удовлетворяет ни критерию А, ни критерию В, то считают, что состав не соответствует требованиям настоящего испытания по оценке консервирования. В таком случае, статус продукта оценивают исключительно по методике оценки микробиологического риска [см. 6.2 с)].
5.7.3 Исследование составов, для которых эффективность нейтрализатора не определена для отдельных штаммов
Если для отдельных штаммов эффективность нейтрализатора не определена, несмотря на дополнительные испытания (см. 5.5.4), считают, что состав не подвержен действию таких штаммов микроорганизмов. Фиксируют в результатах испытания, что состав «не подвержен заражению». В таком случае считают, что этот результат эквивалентен ситуации, когда значение Rх соответствует критериям показателя снижения, заданным в приложении В.
Интерпретацию результатов выполняют для тех штаммов, для которых эффективность нейтрализатора определена, и осуществляют сопоставление показателя Rх c критериями А и В (см. Приложение В и 5.7).
Если все показатели снижения удовлетворяют требованиям критерия А (или В), то считают, что состав соответствует требованиям класса А (или В) настоящего испытания по оценке консервирования.
Если один или более показателей снижения не удовлетворяет критерию А (или В), то считают, что состав не соответствует требованиям настоящего испытания по оценке консервирования.
5.8 Протокол испытания
В протокол испытания вносят следующую информацию:
a) ссылку на настоящий стандарт, ISO 11930;
b) обозначение лаборатории, выполняющей испытания;
c) обозначение косметической продукции (или состава):
1. наименование продукции,
2. номер партии или обозначение даты производства данной партии,
3. наименование лица, ответственного за реализацию продукции, а также наименование производителя, если оно известно,
4. дату поступления в лабораторию,
5. условия хранения в лаборатории;
d) примененный метод подсчета количества микроорганизмов;
e) условия проведения эксперимента:
1. период анализа,
2. условия экспозиции инокулированного состава продукта,
3. состав нейтрализатора,
4. температурный режим культивирования чашек Петри,
5. использованная питательная среда,
6. испытуемые штаммы (происхождение и режим хранения),
7. способ заражения состава продукта тест-микроорганизмами (масса или объем массы продукта, объем калиброванной суспензии);
f) результаты испытания:
1. начальное количество клеток микроорганизмов, Nи N0 [см. 5.6.3.2 а) и 5.6.3.2 b)],
2. результаты демонстрации эффективности нейтрализатора для каждого испытуемого штамма и концентрация состава продукта, для которой получена нейтрализация (в случае отсутствия нейтрализации для отдельных штаммов, описать способ испытания и указать его результаты),
3. результаты испытаний (количество микроорганизмов и логарифмические показатели их снижения) для каждого из испытуемых штаммов и каждого момента отбора аликвот образцов (см. 5.6.3.3 и 5.6.3.4);
g) заключение.
6 Общая оценка антимикробной защиты косметической продукции
6.1 Общая информация
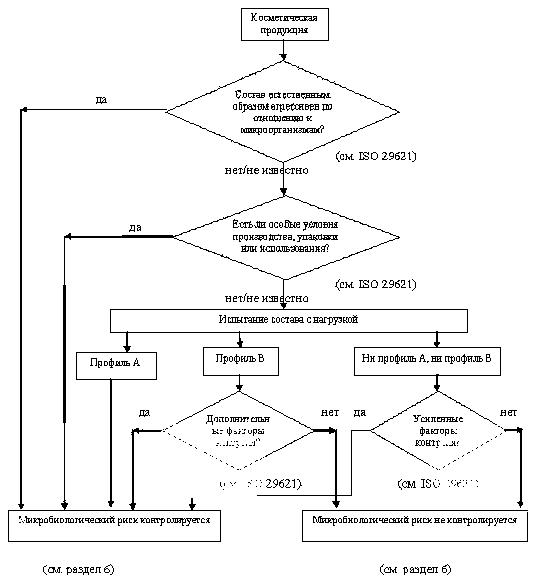
Антимикробную защиту обеспечивают свойства состава продукта, условия производства и конечная упаковка. Общая оценка включает оценку микробиологического риска, а также результаты испытаний на эффективность консервирования, если это необходимо. Процесс описан в диаграмме принятия решений (см. Приложение А). Производитель обязан предоставить информацию, которая подтверждает удовлетворительную степень безопасности и допустимый уровень риска.
6.2 Случай 1 — Испытания на эффективность консервирования проводят по составу продукта
a) Если состав соответствует критерию А, микробиологический риск считают допустимым (косметическая продукция защищена от размножения микроорганизмов, представляющих потенциальную угрозу пользователю), а косметическую продукцию считают соответствующей требованиям настоящего стандарта без дополнительных условий.
b) Если состав соответствует критерию В, выполняют анализ микробиологического риска, включающий исследование дополнительных факторов контроля, не связанных с составом продукта. Например, считается, что защитная упаковка, такая как помпа, обеспечивает большую защиту, чем банка (см. Приложение D). Таким образом, снижение риска осуществляется благодаря специальной упаковке.
Следовательно, если анализ рисков показывает наличие факторов контроля, косметическую продукцию считают соответствующей требованиям настоящего стандарта, так как она удовлетворяет критерию В и содержит средства ограничения микробиологического риска.
c) Если состав не удовлетворяет ни требованиям критерия А, ни В, то статус продукции определяют исключительно по оценке микробиологического риска. Например, продукция, выпущенная в одноразовой упаковке, считается приемлемой, с точки зрения микробиологически низкого риска, даже если состав не удовлетворяет ни критерию А, ни В, если в момент выпуска обеспечены надлежащие микробиологические характеристики.
Примечание - Сведения о микробиологическом риске косметической продукции также могут быть подкреплены другими данными, например информацией об использовании средства пользователями.
Следовательно, если анализ рисков показывает наличие факторов усиленного контроля (снижение риска), то косметическую продукцию считают соответствующей требованиям настоящего стандарта.
d) Если косметическая продукция не удовлетворяет ни одному из трех указанных выше пунктов, ее считают несоответствующей требованиям настоящего стандарта.
6.3 Случай 2 — Испытания на эффективность консервирования состава не проводят
Согласно ISO 29621 лицо, ответственное за производство и реализацию косметической продукции, обязано описать характеристики состава продукта или конечной косметической продукции, а также факторы контроля, которые гарантируют, что микробиологический риск невелик.
Эти характеристики, а также всю сопроводительную документацию, которые показывают, что микробиологический риск является приемлемым, вносят в отчет.
Таким образом, если результаты анализа микробиологического риска показывают, что риск массы (состава) продукта или готового продукта является низким, то косметическая продукция считается соответствующей требованиям настоящего стандарта на основе анализа микробиологического риска, при условии, что ее производят в соответствии с надлежащей практикой организации производства.
Если результаты анализа микробиологического риска показывают, что использование массы продукта или готового продукта связано с недопустимым риском, то считают, что косметическая продукция не соответствует требованиям настоящего стандарта. Чтобы продукция соответствовала настоящему стандарту, то следует принять дополнительные меры по снижению рисков.
Приложение А
(обязательное)
Схема принятия решений
Приложение В
(обязательное)
Критерии оценки испытания на эффективность консервирования (см. 5.7)
Таблица В.1 — Критерии оценки
| Требуемые логарифмические показатели снижения (Rx = logN0 – logNx)a | ||||||||
| Микроорганизмы | Бактерии | C. Albicans | A. Brasiliensis | |||||
| Время отбора проб | Т7 | Т14 | Т28 | Т7 | Т14 | Т28 | Т14 | Т28 |
| Критерий А | ≥ 3 | ≥ 3 и Nlb | ≥ 3 и Nl | ≥ 1 | ≥ 1 и Nl | ≥ 1 и Nl | ≥ 0c | ≥ 1 и Nl |
| Критерий В | Не выполняется | ≥ 3 | ≥ 3 и Nl | Не выполняется | ≥ 1 | ≥ 1 и Nl | ≥ 0 | ≥ 0 и Nl |
|
a В данном испытании допускается отклонение логарифмического показателя до 0,5 (см. 5.7). b N1: без увеличения количества по сравнению с предыдущим замером. c Rx = 0, если lgN0 = lgNx (нет увеличения исходного количества). |
||||||||
Приложение С (справочное)
Примеры нейтрализаторов антимикробного действия консервантов и моющих растворов
Таблица С.1 — Примеры нейтрализаторов антимикробного действия консервантов и моющих растворов
| Консервант | Химические вещества, нейтрализующие антимикробное действие консерванта | Подходящие нейтрализаторы и моющие растворы (для методов с фильтрацией мембраной) |
|
Фенольные вещества: Парабены, феноксиэтанол, фенилэтанол и т.п. Анилиды |
Лецитин Полисорбат 80
Конденсат жирного спирта и окиси этилена Неионогенные ПАВ |
Полисорбат 80, 30 г/дм3 + лецитин, 3 г/дм3. Конденсат жирного спирта и окиси этилена, 7 г/дм3 + лецитин, 20 г/дм3 + полисорбат 80, 4 г/дм3. Нейтрализующая питательная среда D/Ea; питательная среда SDCLPb Моющий раствор: дистиллированная вода; триптон, 1 г/дм3 + NaCl, 9 г/дм3; полисорбат 80, 5 г/дм3. |
| Четвертичные аммониевые соли Катионные ПАВ |
Лецитин, сапонин, полисорбат 80, додецилсульфат натрия Конденсат жирного спирта и окиси этилена |
Полисорбат 80, 30 г/дм3 + додецилсульфат натрия, 4 г/дм3 + лецитин, 3 г/дм3. Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + лецитин, 3 г/дм3. Нейтрализующая питательная среда D/Ea; питательная среда SDCLPb. Моющий раствор: дистиллированная вода; триптон, 1 г/дм3 + NaCl, 9 г/дм3; полисорбат 80, 5 г/дм3. |
| Альдегиды Формальдегид-формирующие вещества | Глицин, гистидин |
Лецитин, 3 г/дм3 + полисорбат 80, 30 г/дм3 + L-гистидин, 1 г/дм3. Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + L-гистидин, 1 г/дм3 + L-цистеин, 1 г/дм3. Нейтрализующая питательная среда D/Ea; питательная среда SDCLPb. Моющий раствор: полисорбат 80, 3 г/дм3 + L-гистидин, 0,5 г/дм3. |
| Окислители | Тиосульфат натрия |
Тиосульфат натрия, 5 г/дм3. Моющий раствор: тиосульфат натрия, 3 г/дм3. |
|
Изотиазолиноны Имидазолы |
Лецитин, сапонин Амины, сульфаты, меркаптаны, бисульфит натрия, тиогликолят натрия |
Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + лецитин, 3 г/дм3. Моющий раствор: триптон, 1 г/дм3 + NaCl, 9 г/дм3; полисорбат 80, 5 г/дм3. |
| Бигуаниды | Лецитин, сапонин, полисорбат 80 |
Полисорбат 80, 30 г/дм3 + сапонин, 30 г/дм3 + лецитин, 3 г/дм3. Моющий раствор: триптон, 1 г/дм3 + NаС1, 9 г/дм3; полисорбат 80, 5 г/дм3. |
| Соли металлов (медь, цинк, ртуть), ртутьорганические соединения |
Бисульфит натрия, L-цистеин Сульфгидрильные соединения, тиогликолевая кислота |
Тиогликолят натрия, 0,5 г/дм3 или 5 г/дм3, L-цистеин, 0,8 г/дм3 или 1,5 г/дм3. Нейтрализующая питательная среда D/Ea; питательная среда SDCLPb. Моющий раствор: тиогликолят натрия, 0,5 г/дм3. |
|
a Нейтрализующая питательная среда Дей/Энгли b Казеинсоевая питательная среда с лецитином и полисорбатом 80 |
||
Приложение D
(справочное)
Характеристики упаковки
Следует принимать во внимание форму упаковки. Форма упаковки играет важную роль в оценке рисков и в определении общей антимикробной защиты косметической продукции.
Форма упаковки или решение использовать многоразовую упаковку во многом влияет на выбор консерванта. Вероятность заражения микроорганизмами возрастает, если у упаковки широкое отверстие, с которым потребитель контактирует напрямую. Аналогично, вероятность привнесения пользователем микроорганизмов снижается, если используется одноразовая упаковка, туба с пипеткой, односторонний клапан, или другие механизмы, препятствующие контакту пользователя с продуктом. Также следует учитывать соответствие размера упаковки количеству продукта, которое используется однократно, так как крупная упаковка, содержащая большее количество продукта, приводит к увеличению срока пользования, благодаря чему возрастает риск заражения. Наличие дополнительных аппликаторов таких, как кисточки, подушечки или тампоны также оказывает влияние на антимикробную защиту.
При оценке рисков продукции, связанных с упаковкой, следует учитывать следующие факторы:
- одно- или многоразовая упаковка;
- размер упаковки;
- способ распределения продукта;
- предположительный срок использования;
- имеет ли упаковка прямой контакт с пользователем;
- герметична ли упаковка.
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
| Обозначение и наименование международного стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
| ISO 16212 Косметика. Микробиология. Подсчет количества дрожжей и плесени | — | |
| ISO 21148 Продукция косметическая. Микробиология. Общие указания по микробиологическому контролю | IDT | ГОСТ ISO 21148-2013 Продукция парфюмерно-косметическая. Микробиология. Общие требования к микробиологическому контролю |
| ISO 21149 Продукция косметическая. Микробиология. Подсчет и обнаружение аэробных мезофильных бактерий | IDT | ГОСТ ISO 21149-2013 Продукция парфюмерно-косметическая. Микробиология. Подсчет и обнаружение мезофильных аэробных микроорганизмов |
| ISO 22716 Продукция косметическая. Надлежащая практика организации производства (GMP). Руководящие указания по надлежащей практике организации производства | IDT | ГОСТ ISO 22716-2013 Продукция парфюмерно-косметическая. Надлежащая производственная практика (GMP). Руководящие указания по надлежащей производственной практике |
| ISO 29621 Продукция косметическая. Микробиология. Руководящие указания по оценке риска и идентификации продукции с микробиологически низким риском | IDT | ГОСТ ISO 29621-2013 Продукция косметическая. Микробиология. Руководящие указания по оценке риска и идентификации продукции с микробиологически низким риском |
| Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта | ||
Библиография
[1] ISO/IEC Guide 51. Safely aspects — Guidelines for their inclusion in standards
[2] EN 12353. Chemical disinfectants and antiseptics — Preservation of test organisms used (or the determination of bactericidal, mycobactericidal, sporicidal and fungicidal activity
[3] IBRAHIM Y.K.E.. GEISS H.K., SONNAG H.-G., Alternatives to the traditional preservatives. SoFW. 118. June 1192
[4] LOCK E.. JAGER M., Antimicrobial food additives; characteristics, uses, effects. Springer (ed). 1995. pp. 122-124
[5] Application of Water Activity Determination to Nonsterile Pharmaceuticals Products, USPC, Inc.. 30(5), 2006, in-process revision: <1112>
[6] CTFA Microbiology guidelines 2007
[7] RUSSELL N.J., GOULD G.W., Food preservatives. Blackie and Son Ltd., 1991. pp. 16-17
[8] DENYERS S., BA1RD R., Guide to microbiological control in pharmaceuticals, 1990. pp. 16-17 and p. 285
[9] RAHMAN M.S.. Handbook of food preservation. Marcel Dekker. Inc., 1999. pp. 95-172 and p. 388
[10] MEIER M., FISHER F.X., KELLER M., HALFMANN H.-J., Influence of alternative propellants on microbial viability in comparison to chlorofluorocarbons. Pharm. Ind. 58. pp 78-82. 1996
[11] DECLERCK J., CAIRE-MAURISIER F., GENOT P., LEVACHER E., MICHAUT A., SCHEIBER G., TARDIVET S., Les gaz propulseurs: les HFC (hydrofluorocarbones) alternatives aux CFC (chlorofluorocarbones) pour les preparations pharmaceutiques pressurisees. SFSTP Pharmapratiques. 16(1). January/February 2006. pp 61-72
[12] BLOOMFIELD S.F., BAIRD R., LEAK RE., LEECH R., Microbial Quality Assurance in Pharmaceuticals. Cosmetics and Toiletries. Elis Horwood Series in Pharmaceutical Technology. 1968. p. 78
[13] SAWYER E., GREEN B., COLTON H., Microorganisms survival in non-CFC propellant P134a and а combination of CFC propellants P11 and P12. Pharmaceutical Technology. March 2001. pp. 90-96
[14] BRANNAN D.K., Packaging's rote in preservation. Cosmetics and Toiletries. 113. Abilene Christian University. Abilene. TX. April 1998
[15] SHARPELL F. and MANOWITZ M., Preservation of cosmetics. Disinfection, sterilization and preservation, fourth edition. Seymour S. Block — Lea & Febiger, 1991
[16] IBRAHIM Y.K.E., SONNAG H.-G., Preservative potentials of some aerosol propellants. Effectiveness in some pharmaceutical oils. Drugs made In Germany, 2, 1995
[17] KABARA J.J., ORTH D.S., Principles for product preservation. Preservative-free and self-preserving cosmetics and drugs, principles and practice, Marcel Dekker. Inc. (ed). New York, 1997, pp. 1-14
[18] FRIEDEL R.R., CUNDELL A.M., The application of water activity measurement to the microbiological attributes testing of nonsterile over-the-counter drug products, Pharmacopeial Forum, 24(2). March-April 1998
[19] BRANNAN D.K., Dille J.C., Type of closure prevents microbial contamination of cosmetics during consumer use, Appl. Environ. Microbiol., 56. 1990. pp. 1476-1479
[20] ENIGL D.C., SORRELS K.M., Water activity and self-preserving formulas. Preservative-free and self-preserving cosmetics and drugs, principles and practice. Marcel Dekker. Inc. (ed). New York, 1997, pp. 45-7
УДК 665.58:006.354 МКС 71.100.70 IDT
Ключевые слова: косметическая продукция, состав продукта, микробиология, антимикробная защита, оценка консервирования

