- Процентная концентрация
Количество вещества а, которое необходимо взять для получения Б (г) раствора концентрацией С (%), вычисляют по формуле а = СБ /100. Тогда количество растворителя В (г) будет равно В = Б – а.
Массовая доля. Например, надо приготовить 300 г (Б) 20%-ного (С) водного раствора NаОН. Количество гидроксида натрия (а) составит: а = (20 • 300) / 100 = 60 г. Для приготовления раствора на 60 г NаОН следует взять растворителя: В = 300 – 60 = 240 г.
При приготовлении водных растворов кристаллогидратов необходимо учитывать содержащуюся в них воду.
Кристаллогидраты – это кристаллические вещества, которые содержат в своем составе воду, называемую кристаллизационной, – например СuSО4 • 5Н2О; Nа2СО3 • 10Н2О.
Расчет количества кристаллогидрата для получения раствора требуемой концентрации производят по формуле
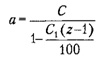
где а – масса кристаллогидрата, которую следует растворить в 100 г дистиллированной воды, г; С – концентрация раствора, мас.% (г/100 г); z = М/М1, (где М – молекулярная масса кристаллогидрата, г; М1 – молекулярная масса безводного вещества, г); С1 – требуемая концентрация безводного вещества в растворе, мас.% (г/100 г воды).
Пример. Из кристаллогидрата СuSО4 • 5Н2О приготовить 20%-ный раствор СuSО4.
Раствор СuSО4 массовой долей 20% содержит: 20 • 100 / (100 – 20) = 25 г СuSО4 на 100 г растворителя; М = 249,68; М1 = 159,60; С1 = 25 г/100 г воды; z = 249,68/159,60 = 1,56; а = 25 – 1,56 / [1 – 25(1,56 – 1) / 100] = 45,34 г.
Для получения 20%-го раствора на 100 г воды следует взять 45,34 г кристаллогидрата СиSО4 • 5Н2О.
Объемная доля. Эту величину чаще используют для характеристики состава газовой среды и растворов, образованных двумя и более жидкостями. Например, объемная доля спирта 96% означает, что в 100 см3 спиртового раствора содержится 96 см3 спирта. Объемная доля азота в воздухе, равная 78 %, означает, что в 100 см3 воздуха содержится 78 см3 азота.
- Молярная концентрация
Пример. Молярный раствор серной кислоты содержит в 1 дм3 раствора 98,08 г Н2SО4
- Моляльная концентрация
Пример. Приготовить моляльный водный раствор гидроксида натрия.
Этот раствор должен содержать 40,00г NаОН в 1 дм3 воды, или 40 • 1000/1040 = 38,4 г в 1 дм3 раствора (моль/кг).
4.Нормальная концентрация
Пример. 0,1 н раствор серной кислоты содержит 98,08 : 2 – 0,1= 4,904 г Н2SО4 в 1 дм3 (98,08 – молекулярная масса серной кислоты).
Пример. 0,01 н раствор перманганата калия содержит 0,316 г в 1 дм3 раствора, так как 1 г-экв. КМnО4 в кислой среде равен 31,606 г.

