Типы порчи пищевых продуктов. Причины микробиологической порчи пищевых продуктов можно разделить на внутренние, внешние, технологические и неявные. Внутренние причины – это физико-химические и структурные характеристики собственно пищевого продукта (активность воды, значение pH, окислительно-восстановительный потенциал, содержание доступных микроорганизмам питательных и нативных антимикробиальных веществ). Внешними причинами называют условия хранения пищевого продукта (температуру, влажность и состав газовой среды, в которой он хранится). Технологическими причинами называют способы физико-химической обработки, нередко приводящие к изменению свойств пищевого продукта и соответственно его микробиоты. Неявные причины – это симбиотические, синергические и антагонистические взаимовлияния микроорганизмов под воздействием указанных выше факторов.
Порча пищевых продуктов происходит в результате сложного комплексного процесса, при котором размножение конкретного микроорганизма, а значит, скорость порчи данного пищевого продукта зависят от типа продукта (внутренние причины), способа его упаковки и хранения (внешние причины).
Размножение микроорганизмов порчи и/или способность вызывать порчу продуктов зависят от взаимодействия микроорганизмов между собой. Например, конкурентоспособность Pseudomonas ssp. повышается благодаря продуцированию сидерофоров, образующих хелатные комплексы с железом; образованию субстратов для реакций порчи одним микроорганизмом с последующим использованием этих субстратов другим (так называемый метабиоз); «включению» реакций метаболизма, приводящих к порче, путем обмена информацией между клетками. Такая комплексность проблемы требует рассмотрения наряду с микроорганизмами, вызывающими порчу, собственно пищевых продуктов как среды для их деятельности.
Поведение микроорганизмов и его регулирование. Для предотвращения микробиологической порчи необходимо знать законы поведения микроорганизмов и их среду обитания. Следует знать микроорганизмы как свойственные данному пищевому продукту, так и вызывающие его порчу. Например, на многих пищевых продуктах присутствуют плесени, которые почти никогда не приводят к их порче. И наоборот, присутствие грибов рода Alternaria требует особого внимания, так как они продуцируют ряд довольно ядовитых микотоксинов. Однако их наличие (без размножения) в хранящемся зерне и пивоваренном сырье может быть показателем их свежести, так как к тому времени, когда они погибнут, зерно уже частично утратит способность к прорастанию.
Практическое использование знаний о конкретных микроорганизмах, вызывающих порчу, и пищевых продуктах, подверженных микробиологической порче, для регулирования микробиологических параметров требует внедрения особых систем, технологий и методов. Наилучшую возможность контроля микробиологической порчи дает подход, основанный на НАССР (Hazard Analysis Critical Control Point) – оценке рисков и критических контрольных точек и соответствующих пререквизитных программах (программах обеспечения обязательных условий типа «правильных методов производства, GMP) с оценкой рисков. Для практической реализации Микробиологической безопасности пищевых продуктов необходимо знать методы выявления, идентификации и количественной оценки как собственно микробиальной порчи, так и вызывающих ее микроорганизмов. Наряду с провокационным тестированием и HACCP-анализом применяются прогностические микробиологические модели. Хотя эти модели предназначены прежде всего для определения роста, выживаемости и инактивации патогенов, постоянно разрабатываются модели для определения микроорганизмов порчи.
Разнообразие микроорганизмов, которые вызывают порчу пищевых продуктов, требует, помимо пределов содержания патогенных микроорганизмов, установления для них соответствующих границ. Многие традиционные способы консервирования были разработаны эмпирически, без полного понимания механизма действия используемого антимикробиального средства. При отказе от использования высокого содержания консервантов процессы переработки необходимо пересмотреть, как и сами основы консервирования. Контроль и регулирование микробиологической порчи по-прежнему являются очень актуальными.
Порчу пищевого продукта можно определить так: любое изменение продукта, делающее его неприемлемым для потребления человеком. Утрата продуктом желаемых свойств и их изменения связаны в основном с размножением микроорганизмов порчи и продуцированием ими внеклеточных ферментов: протеаз, липаз и карбогидраз. Контаминация микроорганизмами пищевых продуктов происходит на любых стадиях производства (начиная со сбора урожая и заканчивая употреблением готового продукта). Многие из них способны размножаться в пищевых продуктах и приводить к их порче. Проявляется микробиологическая порча образованием слизи, видимых невооруженным глазом колоний бактерий, дрожжей или плесеней, выделением газа, помутнением жидких продуктов, обесцвечиванием и изменением вкусовых характеристик. С порчей пищевых продуктов ассоциируется наличие метаболитов: ацетона, метилэтилкетона и диметилсульфона в говядине, этилового спирта, служащего индикатором изменений качества термообработанных продуктов, включая консервы, маринованные куриные грудки, радужную форель, или триметиламина в протухшей рыбе. По некоторым оценкам вследствие микробиологической порчи теряется треть произведенных в мире пищевых продуктов.
С давних пор проблема микробиологической порчи пищевых продуктов известна в пивоварении: пиво портят молочнокислые бактерии, приводя к его помутнению, появлению кислого привкуса и неприятного запаха. Все пищевые продукты: молочные, яйца, фрукты, овощи, соки, рыба, мясо крупного рогатого скота и птицы могут подвергаться микробиологической порче, так как они являются идеальным источником питательных веществ для микроорганизмов.
7.1. ИНДИКАТОРЫ ПОРЧИ ПИЩЕВЫХ ПРОДУКТОВ
В XX в. исследователи пытались увязать обнаруживаемые метаболиты микроорганизмов со степенью порчи мяса, что позволило бы прогнозировать срок его годности. Несмотря на большое число работ по изучению микробиологических изменений на поверхности мяса, физико-химические изменения, происходящие при колонизации микроорганизмами, изучены еще недостаточно. В процессе порчи эти изменения происходят в водной фазе мяса, в которой содержатся низкомолекулярные соединения: глюкоза, глюкоза-6-фосфат, молочная кислота, пируват, глюконат, пропионат, этанол, ацетат, аминокислоты, нуклеотиды, мочевина и водорастворимые белки. Эти субстраты последовательно катаболизирует микрофлора мяса,
У некоторых бактерий снижение содержания глюкозы вызывает переключение с сахарного на аминокислотный путь метаболизма. После утилизации бактериями глюкозы из поверхностного слоя они начинают метаболизировать другие субстраты, в частности свободные аминокислоты. При этом бактерии продуцируют протеолитические ферменты. Признаком утилизации аминокислот считается увеличение концентрации аммиака. Повышение содержания аммиака сопровождается образованием других продуктов метаболизма аминокислот: аминов, индола, скатола и сульфидов, что приводит к появлению характерного неприятного запаха испорченного мяса и повышению значения pH.
Методы идентификации микробиоты порчи. В пищевой промышленности широко используют иммуннологические и молекулярно-генетические методы идентификации. В иммунологических методах используют известные антитела, способные вступать в биохимическое взаимодействие с поверхностными антигенами конкретных бактерий, вызывающих порчу или контаминацию пищевых продуктов (ИФА – ELISA (Enzyme-Linked Immunosorbent Assay) с применением иммуноферментного комплекса на носителе). Иммуноферментные комплексы на носителях используют для обнаружения пищевых патогенов: Escherichia coli 0157:Н7, токсинов, продуцируемых золотистым стафилококком Staphylococcus aureus, и протеаз, выделяемых бактериями порчи рода Pseudomonas. В молекулярно-генетических методах используют так называемые зонды, представляющие собой небольшие однонитевые сегменты ДНК, комплементарные участкам ДНК или РНК индуцируемых микроорганизмов (ПЦР и метод зондов). В случае присутствия в исследуемой пробе ДНК мертвых микроорганизмов при использовании метода ПЦР получают ложно положительные результаты. Проблемы могут возникнуть и вследствие присутствия ПЦР-ингибиторов, которые, как известно, присутствуют в матриксе сырной массы. Метод ПЦР требует затрат времени и поэтому нежелателен при серийных анализах.
Количественные методы определения численности микроорганизмов в пищевых продуктах основаны на измерении АТФ-биолюминесценции, биоэлектрических явлений или микроскопии. Методом измерения АТФ-биолюминесценции устанавливают содержание АТФ в культуре бактериальных клеток. Недостаток метода заключается в том, что АТФ – основной источник энергии для биохимических реакций во всех живых клетках. Довольно много АТФ содержится в пищевых продуктах, что требует отделения микробного АТФ от «фонового». Метод пригоден для определения уровня контаминации оборудования и рабочих поверхностей на пищевых производствах, и там он широко используется.
Методы измерения электрических явлений основаны на измерении изменений силы тока при размножении микроорганизмов. В ходе метаболизма бактерии превращают незаряженные частицы в заряженные, тем самым повышая проводимость данной среды. Среды, используемые в данном методе, могут быть общими или селективными, т.е. применяемыми для всех или только конкретных родов бактерий, дрожжей и плесеней, а также отдельных групп анализируемых пищевых продуктов (например, сыров).
При использовании метода микроскопии микроорганизмы окрашивают флуоресцентными красителями и используют эпифлуоресцентный микроскоп. Проблема состоит в том, что живые и мертвые микроорганизмы окрашиваются одинаково, однако в настоящее время с появлением метода DEFT (Direct Epifluorescent Filter Technique – метод эпифлуоресцентного фильтра) ее удалось решить. Однако данный метод требует больших трудозатрат и затрат времени. Метод совершенствуется – в последнее время появились полностью автоматизированные системы анализа.
Результаты сравнительного изучения методов количественного анализа на примере широко распространенного микроорганизма порчи мясных продуктов Brochothrix thennosphacta позволяют заключить, что проточная цитометрия является наиболее точным методом. Но имеются претензии к скорости данного метода, так как вызывающие порчу микроорганизмы необходимо предварительно изолировать от поверхности мяса, а поскольку они могут образовывать биопленку из гликокаликса, это бывает довольно затруднительно.
С успехом опробовано несколько новых подходов к микробиологическому анализу в целях ускоренного выявления порчи мясопродуктов. Эти методы отнесены к «биосенсорным» – амперометрическим методам обнаружения с использованием ферментных систем и электродов, способных измерять изменения в содержании диаминов, а значит, определять качество куриного мяса. Было показано, что точные результаты можно получить в течение 5 мин, но для подготовки образца с ферментной системой предварительно требуется еще 10 мин.
Сущность других подходов состоит в распознавании и количественной оценке запахов, в частности, с помощью «электронных носов», которые состоят из системы электронных химических сенсоров, подсоединенной к системе распознавания образцов. «Электронный нос» неплохо зарекомендовал себя при микробиологическом анализе мяса и рыбы.
Системы «электронного носа» обладают недостатками: погрешностью в измерениях, утратой чувствительности в условиях повышенной влажности, проблемами точного калибрования, небольшим сроком службы, невозможностью получения количественных данных.
В заключение хотелось бы сказать, что методы обнаружения порчи мясопродуктов в основном не соответствуют своему назначению, очень трудоемки и требуют много времени, поэтому получаемые данные запаздывают и отражают уже изменившуюся ситуацию.
Поскольку микробиологическая порча мясопродуктов представляет собой комплексное явление, усовершенствованные методы обнаружения микроорганизмов станет возможно применять и для анализа других пищевых продуктов, в которых микробиологическая порча не столь разнообразна. Более того, с помощью математических моделей, учитывающих такие факторы, как температура и влажность, эти «ускоренные» методы позволят точно прогнозировать остаточный срок годности и найдут свое место в системах НАССР пищевых производств.
7.2. ИНДИКАЦИЯ, ИДЕНТИФИКАЦИЯ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ДРОЖЖЕЙ, ВЫЗЫВАЮЩИХ ПОРЧУ ПИЩЕВЫХ ПРОДУКТОВ
Наличие в пищевых продуктах сахаров, органических кислот и других источников углерода, как и низкое значение рН, способствует порче продуктов под действием дрожжей. Признаками дрожжевой порчи служат различные образования на поверхности мяса и сыра, а также брожение сахара в жидких и полужидких продуктах.
Среди дрожжей, вызывающих порчу пищевых продуктов (ДВПП), встречается довольно много видов, как аскомицетов, так и базидиомицетов.
Дрожжи, поражающие разные пищевые продукты, отличаются избирательностью. Безалкогольные напитки, сиропы, салатные дрессинги чаще подвергаются воздействию Zygosaccharomyces, а пиво и вино – Bretianomyces, Saccharomyces и ряда дрожжей других родов. В образцах испорченных мяса и сыров зачастую обнаруживается повышенное содержание дрожжей. Учитывая большое разнообразие возможных таксонов, правильная идентификация видов зачастую представляет большую проблему.
7.2.1. Индикация и количественный учет дрожжей
При установлении причин порчи продукта необходимо поставить вопрос: следствием чего являются наблюдаемые изменения – размножения микроорганизмов, изменений в рецептуре или условий хранения. При высокой степени порчи продукта микроорганизмы, ее вызвавшие, могут быть обнаружены обычной микроскопией при 400- или 500-кратном увеличении. Дрожжи при микроскопии окрашивают кристаллическим фиолетовым. Для этого маленькую каплю 0,5%-го кристаллического фиолетового вносят в продукт непосредственно на предметном стекле или смешивают с небольшим количеством продукта, разбавленным дистиллированной водой (1 : 10). Микроскопическое исследование позволяет идентифицировать микроорганизм, вызвавший порчу.
Индикацию дрожжей из испорченных пищевых продуктов осуществляют методом посева на разные питательные среды. Рекомендуется использовать среду на основе дихлорана бенгальского розового агара с хлорамфениколом (DBRC для выделения как плесеней, так и дрожжей. Среда ограничивает рост колоний плесеней, позволяя произвести более точный подсчет колоний. ДВПП обычно хорошо размножаются при 25°С на стандартном солодово-дрожжевом агаре (3 г дрожжевого экстракта, 3 г солодового экстракта, 5 г пептона, 10 г глюкозы, 20 г агара, 1 л воды, рН 5–7). Эту среду используют как для обнаружения, так и количественного определения стандартным методом чашечного подсчета. Необходимо растворить образец в 0,1%-м пептонном бульоне. Значение рН солодово-дрожжевого агара близко к нейтральному, поэтому рН среды доводят до 4,5 с помощью раствора соляной кислоты.
При анализе пищевых продуктов микробиологи широко используют МЕА (агар на солодовом экстракте) и TGY (агар на триптоноглюкозном дрожжевом экстракте), причем последний более предпочтителен. Ускоренное обнаружение дрожжей, стойких к консервантам (Z. bailii и Z. bisporus), проводят на подкисленной МЕА (например, МАА, уксуснокислый солодовый агар) или подкисленной TGY (TGYA). В основную питательную среду (МЕА или TGY) добавляют 0,5%-й уксусной кислоты. Колонии дрожжей обычно становятся различимыми через 3–7 сут. Колонии могут быть представлены более чем одним видом дрожжей (из-за сходства внешнего вида колоний это может быть сначала незаметно). При попытке индикации Zygosaccharomyces (например, Z. bailii) и других видов дрожжей время, необходимое для их обнаружения в продукте, можно сократить путем инкубирования чашек с агаром при 30°С вместо 25°С. Следует учитывать, что некоторые виды дрожжей осмофильны (в частности, Z. bailii, Z. bisporus, Z. rouxii), поэтому для посева можно использовать высокоосмотические питательные среды на основе YM или TGY с добавлением 40% глюкозы. Разведенный образец окажется также высокоосмотичным (например, 0,1%-й пептонный бульон с 40% глюкозы).
Для обнаружения отдельных видов Zygosaccharomyces и других дрожжей разработан ряд специальных кулътуральных сред, обладающих различной эффективностью. К ним относится, в частности, лизиновый агар, применяемый для различения видов дрожжей-несахаромицетов, когда они встречаются вместе с Saccharomyces cerevisiae, поскольку последние не утилизируют лизин как источник азота. Из охлажденных приправ были случайно выделены психрофильные виды Mrakia и Rhodosporidium, вызывающие порчу пищевых продуктов при низких температурах. Для выделения указанных видов дрожжей может понадобиться инкубация образцов таких пищевых продуктов при температуре 5–10°С.
Таким образом, основным способом обнаружения ДВПП является посев проб и ожидание проявления видимых признаков размножения микроорганизмов.
Метод не лишен недостатков, главный из которых – затраты времени. Метод измерения импеданса основан на свойстве микроорганизмов при размножении изменять электропроводность питательной среды. Этот метод был использован для обнаружения дрожжей, вызывающих порчу вина. В качестве метода оценки концентрации микроорганизмов в пищевых продуктах и напитках применяется также измерение АТФ-биолюминесценции, так как АТФ содержится во всех живых клетках. С его помощью невозможно идентифицировать отдельные их виды. При анализе напитков имеется другая возможность – продукт пропускают через мембранный фильтр, после чего проводится окрашивание клеток и их подсчет под микроскопом. Разработано несколько методов, основанных на анализе ДНК и позволяющих проводить ускоренное обнаружение и количественную оценку микроорганизмов, вызывающих порчу пищевых продуктов.
К методам идентификации дрожжей относят выявление морфологии клетки, определение способов формирования плодовых образований, способов сбраживания углеводов и утилизации азот- и углеродсодержащих соединений. Постоянно встает вопрос: насколько точны традиционные методы идентификации видов? Кстати, виды дрожжей, описанные до 1980 г., были идентифицированы традиционными фенотипическими методами. При сравнении с результатами идентификации на молекулярном уровне правильными оказались более половины из них. В ходе недавних исследований в области идентификации дрожжей около 75% ранее «неизвестных» видов было определено традиционными методами. На основании изложенного можно утверждать, что фенотипические методы до сих пор себя не изжили, хотя они требуют больших затрат труда и времени.
Фенотипическое описание дрожжей включает следующие этапы:
- определение способа деления клеток. Выявление способов размножения (почкованием или делением клеток), определение морфологии клеток (рис. 7.1);
- выявление наличия или отсутствия гифов и псевдогифов:
- выявление наличия или отсутствия половых образований;
- выявление способности сбраживать углеводы;
- определение способности к размножению на определенных углерод- и азотсодержащих, а также на других специфических культуральных средах.
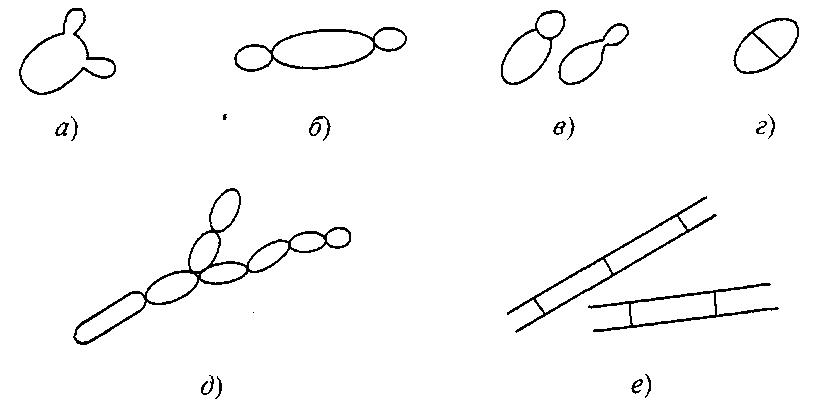
Рис. 7.1.
Вегетативное размножение:
а – мультилатеральное почкование; б – биполярное почкование;
в – полярное почкование на широком (слева) и узком (справа) участках;
г – деление клетки; д – псевдогифы; е – истинные гифы
Вегетативное размножение. Виды дрожжей родов Saccharomyces, Zygosaccharomyces делятся путем мультилатерального почкования (рис. 7.1, а), тогда как Hamemaspora – путем биполярного почкования (рис. 7.1, б). Базидиомицетам также свойственны разные типы почкования. Большинство из них размножается путем полярного почкования
(рис. 7.1, в) – либо на узком основании, либо вблизи полюсов. Некоторым базидиомицетам свойственно типичное мультилатеральное почкование, тогда как другим свойственно и почкование, и деление (рис. 7.1, г). При исследовании молодой (24–48 ч) быстро развивающейся культуры почкующиеся клетки легко распознаются. Клетки же, размножающиеся делением, вскоре образуют концентрическую колонию вокруг исходной, так что способ размножения в данном случае не очевиден.
Дрожжи рода Candida (синоним Torulopsis) идентифицируют по критерию образования псевдогифов, причем признается, что, хотя некоторые виды, классифицируемые как Torulopsis, образуют псевдогифы (рис. 7.1, д), мицелий такого типа образуют не все штаммы дрожжей рода Candida. Образование истинных гифов также может служить признаком, используемым для различения штаммов (рис. 7.1, е).
Половые образования. Половые образования нередко формируются перед конъюгацией, которая происходит или между отдельными клетками, или между клеткой и ее почкой (рис. 7.2). Если в качестве конъюгата выступает почка, то место соединения зачастую слегка удлиняется и стенка почки под микроскопом может выглядеть тоньше. Виды, для которых характерна конъюгация между клеткой и ее почкой, почти всегда гомоталломны.
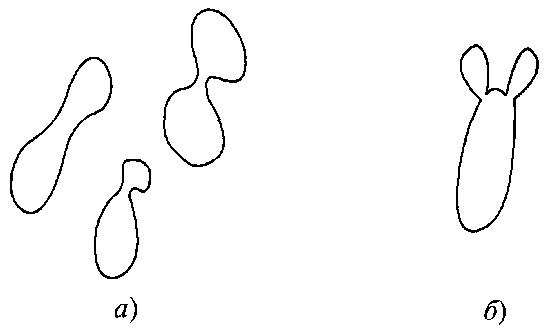
Рис. 7.2.
Типы конъюгации клеток:
а – конъюгация между отдельными клетками;
б – конъюгация между клеткой и ее почкой, слегка удлиненной
Неконъюгированные аски образуются как гомо-, так и гетероталломными диплоидными штаммами. Неспособность штаммов формировать половые образования может свидетельствовать об отсутствии необходимых условий или о принадлежности данной культуры к родственному типу.
Большинство микробиологических лабораторий идентифицирует ДВПП фенотипическими методами. Они очень трудоемки, требуют продолжительного времени и зачастую дают неопределенный результат. Повысить надежность идентификации позволяяет способ с использованием микротитровальных кювет, включающий сравнительно большое количество тестов, основанных на процессах культивирования. Но если при использовании стандартных тестов существует определенная вероятность ошибочности идентификации, не следует ожидать большей точности и от ускоренных методов идентификации.
Методы анализа на молекулярном уровне являются быстрым и точным средством идентификации видов микроорганизмов. Их можно использовать в том числе и для обнаружения новых видов ДВПП. Потребность в количественной оценке генетического сходства штаммов и видов на молекулярном уровне была удовлетворена, в частности, благодаря методике реассоциации или гибридизации ядерной ДНК. ДНК из двух представляющих интерес видов разделяют, смешивают и выделяют однонитевую последовательность, после чего степень сходства определяют по уровню реассоциации. Для измерения применяют различные способы: как спектрофотометрические, так и с помощью радиоизотопов или других маркеров. Результат измерения комплементарности ДНК обычно выражают процентом связанности, но он может вводить в заблуждение, так как цепочки ДНК перед дуплексированием должны иметь подобие базовых сегментов не менее 75–80%, а результаты должны соотноситься со шкалой сходства. Существенное влияние на образование двойной спирали ДНК оказывают условия эксперимента, однако при проведении измерений в оптимальных условиях различные методы оценки сходства ДНК дают практически одинаковый результат. Процент сходства ДНК позволяет примерно оценить общее подобие геномов двух микроорганизмов, однако данным методом невозможно обнаружить различия в одном гене или безошибочно определить плоидность, хотя в некоторых случаях может быть выявлена анеуплоидия.
Основной вопрос: как интерпретировать данные о реассоциации ДНК? Считается, что по общему фенотипу штаммы с 80%-м и более сходством ядерной ДНК относятся к одному виду дрожжей. Данное положение было проверено на основании концепции биологического вида – насколько способность к воспроизведению отдельных штаммов связана с разной степенью сходства ДНК. Было показано, что виды с 25%-м сходством ДНК дают огромное число способов межвидового спаривания, но при этом образование асков ограничено, а аскоспоры вообще не образуются. Поскольку видовые барьеры очень сложны и определяются разными факторами, индикатором принадлежности микроорганизмов к одному виду должно считаться сходство ДНК в 70–100%.
Наиболее надежным молекулярным методом сегодня представляется определение последовательностей ядерно- и митохондриально-кодированных генов, однако собственно процесс секвенирования гена можно провести далеко не в каждой лаборатории. Следовательно, необходима разработка ускоренных и простых в применении методов идентификации на молекулярном уровне. Благодаря методам, основанным на полимеразной цепной реакции (снятие «отпечатков пальцев» ПЦР-микросателлитов, типирование), в настоящее время существует возможность дифференциации отдельных штаммов ДВПП, принадлежащих как к одному виду, так и к разным видам, а также установления источника их происхождения. Но эти методы типирования, скорее всего, вскоре будут вытеснены методами с использованием зондов, чипов и т.п.
7.3. ИНДИКАЦИЯ, ИДЕНТИФИКАЦИЯ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ПЛЕСЕНЕЙ, ВЫЗЫВАЮЩИХ ПОРЧУ ПИЩЕВЫХ ПРОДУКТОВ
В процессах порчи пищевых продуктов и их ферментации участвуют плесени, представляющие собой гифовые грибы, некоторые виды которых продуцируют микотоксины. Меры контроля роста плесеней в пищевых продуктах путем предотвращения попадания их спор в пищевые продукты, посредством регулирования температуры, влажности и содержания кислорода в условиях хранения изделий, с помощью консервантов и других пищевых добавок полностью не исключают возможности воздействия плесеней на качество и безопасность пищевых продуктов. Поэтому необходимо уметь их обнаруживать в готовых изделиях, а также в ходе процессов переработки, упаковки и хранения пищевых продуктов.
До середины XX в. плесени идентифицировали методом культивирования на питательных средах в чашках Петри с последующим микроскопированием. В дальнейшем для подавления размножения бактерий питательные среды начали подкислять, что способствовало размножению дрожжей и плесеней, однако особо специфической среды подобрать не удалось. Впоследствии подкисленные питательные среды были заменены средами с антибиотиками, биохимическими реагентами или красителями, замедляющими рост бактерий и позволяющими развиваться дрожжам и плесеням.
7.3.1. Современные методы количественного определения плесневых грибов
Методы посева. Образец взвешивают, смешивают с разбавителем и помещают на агар, после чего чашки инкубируют при заданной температуре в течение 5 сут. Одновременно подсчитывают плесени и дрожжи, так как плесени вполне отличимы от дрожжей по характерным гифам. Масса образца может составлять от 5 до 400 г; образец смешивают с 0,1%-м понтонным бульоном и разбавляют в пропорции 1 : 10 или 1 : 5. Любой фрагмент мицелия, имеющий неповрежденные ядро и споры, способен образовывать колонии.
Для количественного определения плесеней используют несколько сред, поскольку универсальной среды до сих пор не разработано. Рекомендуется использовать агар Чапека, декстрозный агар Сабуро, глюкозный агар на основе дрожжевого экстракта, агар на солодовом экстракте, питательную среду общего назначения – агар для определения микробного числа с добавлением по 100 мг хлорамфеникола и хлортетрациклина.
Следует отметить: одно из ограничений методов количественного определения плесеней состоит в том, что не существует одной универсальной среды для выделения и количественного определения всех видов плесеней для всех возможных пищевых продуктов. Поэтому рекомендуется применять различные культуральные среды.
Поскольку в большинстве пищевых продуктов может развиваться несколько видов плесеней, для микологического анализа таких продуктов может потребоваться несколько сред и разные условия инкубирования, особенно если требуется определить не только их количество. Еще одним лимитирующим фактором является отсутствие единых правил по выбору антибиотика для подавления размножения бактерий.
Методы фильтрации. Сущность метода, в котором применяется гидрофобный мембранный фильтр, заключается в том, что в процессе фильтрации жидкий образец (или твердый в растворе) проходит через фильтрующий элемент с предварительным фильтром (размер пор – 5 мкм; используется для удаления частиц пищевого продукта). За первым расположен второй мембранный фильтр (размер пор – 0,45 мкм) с гидрофобной сеткой, способный улавливать отдельные клетки. Этот фильтрующий элемент помещают в чашку Петри на агар КМ-11, содержащий краситель-индикатор и антибиотик, и проводят инкубирование при температуре 25 ± 1°С в течение 50 ± 2 ч, после чего подсчитывается количество ячеек с колониями.
Методы подсчета гифов по Ховарду. Данный метод основан на стандартизированном методе, с помощью которого вычисляется процент микроскопических полей с гифами плесени, которые превышают по размеру 1/6 диаметра поля. Перед тем как использовать данный метод, необходимо научиться различать клеточную ткань продукта, не содержащего плесени, структуры инородных включений животного или растительного происхождения и собственно плесени. Гифы плесени состоят из продольных трубок, поперечных перегородок, разделяющих гиф на отдельные участки, клеточного материала в форме гранул, разветвлений гифов, их концов, не способных преломлять свет, однако не в каждом образце все они присутствуют.
Растущие на поверхности пищевых продуктов плесени могут быть идентифицированы опытными микологами на уровне рода путем визуального наблюдения и микроскопии. Стерильной инокуляционной спицей проводят сквозь колонию плесени и под ее поверхностью, захватывая отдельные фрагменты мицелия. Материал переносят на двойное предметное стекло. Если плесень не сходит со спицы, ее смачивают каплей 70%-го этанола и удаляют краешком покровного стекла. Препарат исследуют под микроскопом при 40-кратном увеличении. Если для анализа цельных или дифференцированных структур требуется большее увеличение, то на покровное стекло наносят одну каплю иммерсионного масла и повышают увеличение до 100-кратного.
Изолированные из пищевых продуктов методом посева плесени идентифицируют путем микроскопии в соответствии с методами анализа, рекомендуемыми в справочниках по таксономии плесеней пищевого происхождения. Существует список таксономических признаков для идентификации выделяемых из пищевых продуктов плесеней. Полезны также руководства по таксономии плесеней отдельных родов – Aspergillus, Fusarium и Penicillium. Традиционно плесени определяют по таксономическим «ключам», в которых описаны их макроскопические и микроскопические характеристики после выращивания на селективной среде при определенной температуре в течение заданного времени.
Разрабатываются новые методы и аналитическое оборудование с целью идентификации плесеней – это разработка иммунологических тест-наборов, определение летучих соединений, молекулярные методы, основанные на анализе нуклеиновых кислот,
ИК-спектроскопия и другие системы распознавания спектров.
Иммунологические тест-наборы разработаны для Altemaria, Aspergillus, Botrytis, Cladosporium, Fusarium, Geotrichum, Monascus, Mucor, Penicillium и Rhizopus. В тест-наборах используют антитела к компонентам клеточных стенок, внеклеточных полисахаридов и гликопротеинов плесеней. Имеется неспецифичный тест-набор на основе метода ELISA, способный обнаруживать в смеси шести родов плесеней (Aspergillus, Cladosporium, Fusarium, Geotrichum, Mucor и Penicillium), а также плесени 10 других родов. Разработаны тест-наборы для обнаружения плесеней, продуцирующих микотоксины: афлатоксин, трихоцетен и фумонизин.
Для контроля роста плесеней модифицируются и некоторые бактериологические методы, в частности проточная цитометрия, основанная на подсчете количества отдельных клеток в жидкости по мере их прохода через сенсорный датчик. Методы проточной цитометрии используются для обнаружения плесеней в воздухе с помощью разных параметров: размера частиц, гранулярности (бокового светорассеяния) клетки, а также красной флуоресценции при длине волны 620 нм после окрашивания и микроволнового облучения при мощности 440 Вт и частоте 2450 МГц в течение 30 с.
Разрабатываются современные методы идентификации плесеней: биосенсоры на основе ДНК и РНК, масс-спектроскопия, биолюминисцентные и другие подобные системы для их обнаружения в пищевых продуктах.
7.4. ПОРЧА ПИЩЕВЫХ ПРОДУКТОВ И МИКРОБИОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ
Микробиологическую опасность, связанную с порчей пищевого продукта сапрофитными микроорганизмами, и микробиологическую опасность продукта, обсемененного патогенными микроорганизмами, следует разделять. И это понятно, потому что большинство патогенных микроорганизмов, встречающихся в пищевых продуктах, не вызывает их порчи (опасный продукт может иметь хорошие органолептические свойства). В то же время микроорганизмы порчи, не являясь патогенными, могут продуцировать токсины и микотоксины, а размножение некоторых микроорганизмов порчи может сопровождаться образованием биогенных аминов, в частности гистамина.
Биогенные амины имеют природное происхождение, они продуцируются в больших количествах также микроорганизмами порчи под действием декарбоксилаз аминокислот. Биогенные амины обнаруживаются в таких продуктах, как вино, ферментированные мясо- и рыбопродукты, сыры и квашеные овощи. Чрезмерное потребление этих аминов связано с риском для здоровья.
Некоторые микроорганизмы порчи могут привести к пищевым отравлениям, но степень их патогенности не ясна или дискуссионна. Существуют микроорганизмы порчи, которые можно отнести к патогенам с умеренной патогенностью (например, некоторые виды аэромонад, Aeromonas spp.). Такие патогены обычно безвредны, но при ослабленном иммунитете они могут поражать ткани, вызывая заболевание.
Непатогенная микробиота пищевых продуктов может взаимодействовать с патогенными микроорганизмами и влиять на их рост, может ему способствовать. Это так называемый метабиоз, когда одни микроорганизмы изменяют условия окружающей среды так, что становится возможным размножение других. Это зачастую связано с изменением значения рН. Известны результаты исследований, согласно которым рост некоторых дрожжей, плесеней или бактерий порчи в кислых продуктах приводит к такому увеличению значения рН, что становится возможным размножение бактерий Clostridium botulinum и продуцирование ими токсинов. Мягкая бактериальная гниль плодов ведет к увеличению концентрации в них бактерий рода Salmonella и их преобладанию над другими микроорганизмами. Гриб Clomerella cingulata стимулирует размножение Listaria monocytogenes на яблоках, a Penicillium expansum их размножение подавляет.
Во многих странах микробиологический критерий безопасности продукта основан на наличии или отсутствии микроорганизмов, их численности, включая паразитические виды, а также на содержании их токсинов или метаболитов (на единицу массы, объема, площади продукта или партии). Бывает, что микробиологические критерии закрепляют в стандартах, рекомендуют и фиксируют в технических условиях. Закрепленный в стандарте микробиологический критерий указан в нормативном акте, а его выполнение обязательно (обычно он касается вопросов пищевой безопасности). Принятые техническими условиями критерии применяются для сырья, ингредиентов или готовых изделий, являющихся предметом договоров купли-продажи.
Рекомендуемые критерии разрабатываются разными органами – предприятиями и организациями пищевой промышленности, контролирующими организациями, национальными и международными комиссиями, они чаще всего относятся к микроорганизмам-индикаторам.
7.4.1. Микробиологическая порча молока и молочных продуктов
Молоко является прекрасной средой для размножения микроорганизмов. Рост нежелательных микроорганизмов отрицательно влияет на выход продукции, срок ее годности и органолептические показатели, что приводит к экономическим потерям.
По-прежнему актуальными остаются проблемы выявления источников контаминации и контроля роста микроорганизмов в сыром молоке и переработанных молочных продуктах. К улучшению их качества, увеличению срока годности и уровня безопасности привело не только внедрение нормативов и стандартов на качество молока, но и применение новых технологий санитарно-гигиенической обработки оборудования и помещений, а также процессов сбора, переработки сырья и дистрибьюции молочных продуктов.
Так как молоко – источник питательных веществ для многих групп и видов микроорганизмов порчи, в качестве примера будут рассмотрены характерные для молока и молочных продуктов источники контаминации, а также ее последствия для качества продуктов из сырого и обработанного молока.
Разнообразие микроорганизмов порчи сырого молока. Мерой риска порчи молока, индикатором здоровья молочного стада, санитарно-гигиенических условий при дойке и хранении молока является численность бактерий в сыром продукте. Микробиологическая безопасность молока непосредственно влияет на выход и качество молочных продуктов. Количество микроорганизмов в сыром молоке может изменяться в очень широких пределах: от > 10 КОЕ/см3 в молоке, полученном асептическим способом от здоровых коров, до > 1 · 106 КОЕ/см3. Источниками контаминации молока микроорганизмами являются вымя, сосковый канал и оборудование. Стандарты разных стран по сырому молоку отличаются друг от друга. Они обычно устанавливают численность микроорганизмов, максимально допустимую для обеспечения безопасности и качества молочных продуктов.
Количество начальной микрофлоры в сыром молоке зависит от технологии получения, сбора молока и обращения с ним.
Микрофлора сырого молока представлена чаще всего молочнокислыми бактериями Streptococcus spp., Pseudomonas spp., Staphylococcus spp., Micrococcus spp. и дрожжами. К порче готового продукта приводят микроорганизмы сырого молока. На скорость порчи существенно влияют температура и продолжительность хранения сырого молока. Все присутствующие в сыром молоке микроорганизмы делят по оптимальным для их размножения интервалам температур на мезофильные, психротрофные и термотолерантные.
При увеличении числа молочнокислых микроорганизмов и сбраживании ими лактозы молоко приобретает кислый вкус и происходит створаживание казеинатов при нагревании. Использование эффективных систем охлаждения сырого молока предотвращает его порчу из-за воздействия молочнокислых бактерий. Хранение сырого молока при температуре 4°С в течение 24 ч приводит к изменению популяции бактерий от мезофильных (типа молочнокислых бактерий) к психротрофным (например, Pseudomonas spp.). Когда сырое молоко быстро охлаждают и хранят при соответствующих температурных режимах (охлаждение до 7°С и ниже в течение 2 ч после получения), основной задачей поддержания его качества становится контроль наличия психротрофных организмов.
Психротрофы молока. Pseudomonas, Enterobacter, Flavobacterium, Klebsiella, Acinetobacter, Achromobacter, Aeromonas и Alcaligenes относятся к грамотрицательным бактериям сырого молока. К грамположительным психротрофным бактериям относятся Coryneliacierium, Microbacterium, Micrococcus и спорообразующие Bacillus и Clostridium. В сыром молоке преобладают Pseudomonas spp. Часто встречаются в сыром молоке виды Pseudomonas: Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas fragi и Pseudomonas aeruginosa. Некоторые из названных видов продуцируют термоустойчивые липолитические и протеолитические ферменты, выдерживающие пастеризацию, что объясняет причины ухудшения качества молока в течение срока годности готового продукта даже при уничтожении исходных бактерий при пастеризации.
Причинами загрязнения сырого молока психротрофами являются плохие санитарно-гигиенические условия на фермах и ненадлежащим образом вымытое технологическое оборудование.
Термотолерантные микроорганизмы молока. Термотолерантные виды микроорганизмов выделяют как из сырого, так и из обработанного молока. Термотолерантные спорообразующие микроорганизмы, выдерживающие пастеризацию и способные к размножению в термообработанных продуктах в условиях холодильного хранения, ухудшают качество продукта и сокращают срок его годности. Эти микроорганизмы могут выживать при пастеризации или других способах высокотемпературной обработки молока. Они проникают в сырое молоко из окружающей среды (например, из подстилки для скота) или с производственного оборудования. К термоустойчивым микроорганизмам сырого молока относятся Microbacterium, Micrococcus, Bacillus, Alcaligenes, Corynebacterium и Clostridium. Порчу молока чаще всего вызывают Bacillus spp. и Paenibacillus spp. – они способны к размножению в условиях холодильного хранения и снижению качества готового продукта.
Нередко в молоко попадают микроорганизмы от коров, больных маститом, которые увеличивают общую численность бактерий молока. К ним относятся Streptococcus agalactiae, Streptococcus uberis и Staphylococcus aureus. Наличие в молоке сборных танков таких микроорганизмов, как Streptococcus uberis, связано не только с маститной инфекцией, но и плохо вымытым оборудованием.
Микроорганизмы, вызывающие инфицирование вымени, могут присутствовать в сыром молоке в больших количествах. От больных маститом коров в молоко попадают также соматические клетки, способные ухудшать качество молока. Показатель числа соматических клеток используют в качестве индикатора качества молока. Высокое значение числа соматических клеток свидетельствует о наличии в стаде маститной инфекции. Из пороков вкуса и запаха в этих продуктах отмечаются прогорклость и горечь.
Контроль степени контаминации сырого молока при его сборе, транспортировке и хранении является определяющим фактором обеспечения безопасности готового молочного продукта и его качества.
Микробиота порчи молочных продуктов.
Гнилостные бактерии. По морфологическим и физиологическим признакам гнилостные бактерии принято делить на четыре группы:
- спорообразующие и неспорообразующие аэробы;
- спорообразующие анаэробы;
- неспорообразующие анаэробы;
- факультативные анаэробы.
Споры бактерий рода Bacillus обладают высокой термоустойчивостью и выдерживают пастеризацию, а в некоторых случаях стерилизацию молока. Вследствие высокой активности протеолитических и липолитических ферментов эти бактерии вызывают гидролиз белков и жиров с появлением в продукте горького и прогорклого вкуса. Развитие В. cereus и В. mycoides приводит к «сладкому» свертыванию (при низкой кислотности) сливок, сгущенного стерилизованного молока.
Аэробные спорообразующие бактерии. К типичным гнилостным аэробным палочкам, образующим эндоспоры, относятся Bacillus subtilis, Bacillus megatherium, Bacillus mycoides, B. circulans, B. licheniformis, B. Cereus, обладающие высокой протеолитической активностью (разжижают желатин, свертывают и пептонизируют молоко, выделяют аммиак). Bacillus subtilis (сенная палочка) – прямые палочки с закругленными концами, иногда они располагаются короткими цепочками, окраска по Граму положительная, в молодых культурах подвижны (перитрихи). Размеры клеток – (0,6–0,7) × (3–5) мкм. Сенная палочка образует эндоспоры, располагающиеся центрально, причем диаметр спор превышает диаметр клетки. Колонии на мясопептонном агаре (МПА) имеют серо-белый цвет, они сухие и бугристые. При росте в мясопептонном бульоне (МПБ) на поверхности образуется сухая морщинистая пленка, бульон сначала мутнеет, а затем становится прозрачным. Оптимальная температура роста составляет 37°С, температурный диапазон – от 5 до 55°С. Bacillus megatherium – крупная палочка размером (1,5–2,0) × (3,5–7,0) мкм; она грамположительна, подвижна, располагается чаще всего цепочками, образует споры, располагающиеся в центре клетки, капсул не формирует.
Аэробные неспорообразующие бактерии. К этой группе относятся бактерии родов Pseudomonas, Flavobacterium, Alcaligenes. Бактерии рода Pseudomonas – прямые или слегка изогнутые палочки размером (0,5–1,0) × (1,5–5,0) мкм, грамотрицательные, подвижные за счет одного или нескольких полярных жгутиков, спор и капсул не образуют, аэробы, окидазо- и каталазоположительные. Оптимальная температура их роста составляет
18–22°С, температурный диапазон роста — 4–41°С. Колонии на плотной среде блестящие, с ровными краями, часто окрашенные благодаря наличию пигментов: желто-зеленого у P. fluorescens, синевато-зеленого у Pseudomonas aeruginosa, желто-оранжевого у Р. alkaligenes. Имеются и нефлюоресцирующие виды, например P. fragi. Типовой вид – Pseudomonas aeruginosa.
Псевдомонады являются доминирующими представителями психротрофных бактерий сырого молока. Чаще всего встречаются Р. fluorescens, P. putida, P. fragi, Р. aeruginosa. Многие виды псевдомонад продуцируют термоустойчивые липазы и протеазы, которые выдерживают пастеризацию молока и, несмотря на гибель вегетативных клеток, вызывают порчу молочных продуктов в процессе их хранения.
Факультативно-анаэробные неспорообразующие бактерии. К этой группе бактерий относятся некоторые представители семейства Enterobacteriaceae (роды Escherichia, Proteus, Serratia) и рода Aeromonas.
Escherichia coli (кишечная палочка) – мелкие палочки размером (1,0–1,5) × (2–3) мкм, одиночные или парные, грамотрицательные, подвижные (перитрихи), спор и капсул не образуют, каталазоположительные, оксидазоотрицательные. Оптимальная температура роста составляет 37–39°С. На МПА палочка образует бесцветные, блестящие, слегка слизистые колонии с гладкой поверхностью и ровными краями. Кишечная палочка обладает слабой протеолитической активностью. Она не гидролизует молекулы казеина и свою ферментативную активность проявляет лишь на стадии расщепления пептонов.
Proteus vulgaris (палочка протея) – прямые палочки размером (0,4–0,8) × (1,2–3,0) мкм, грамотрицательные, подвижные (перитрихи). Клетки имеют многочисленные фимбрии. Спор, капсул и пигментов не образуют. Представители рода Proteus легко идентифицируются благодаря своей способности к роению. Через несколько часов после посева в конденсационную воду свежеприготовленного мясопептонного агара наблюдается роение микроба, его ползучий рост. Поверхность МПА покрывается тонкой вуалеобразной полупрозрачной пленкой. Оптимальная температура роста микроба составляет 37°С, благоприятное значение pH – нейтральное. Палочка протея при расщеплении белков образует сероводород, индол.
Serratia marcescens – прямые палочки размером (0,5–0,8) × (0,9–2,0) мкм, подвижные, грамотрицательные, при определенных условиях способные образовывать капсулу. Выделяет пигмент ярко-красного цвета – продигиозин, за счет чего на МПА вырастают мелкие круглые блестящие колонии ярко-красного цвета, похожие на капли крови, отсюда названные «чудесной палочкой». Оптимальные: температура роста — 22–25°С, pH – 6,5. Расщепляет белки с образованием сероводорода, аммиака, индола.
Род Aeromonas – мелкие палочки с закругленными концами размером (0,3–1,0) ×
× (1,0–3,5) мкм. Располагаются одиночно, парами или короткими цепочками. По Граму окрашиваются отрицательно, подвижные за счет одного полярного жгутика. Оптимальный диапазон температуры роста составляет 22–28°С. Оксидазо- и каталазоположительные. Типовой вид – Aeromonas hydrophila.
Анаэробные спорообразующие палочки. Clostridium putriflcus – длинные палочки размером (0,4–0,7) × (7–9) мкм, располагаются одиночно или цепочками, грамположительные, подвижные (перитрихи). Образуют эндоспоры, которые смещены от центра, их диаметр превышает диаметр клетки. Каталазоотрицательные. Штаммы этого вида обладают сильно выраженной протеолитической активностью: разжижают желатин и кровяную сыворотку, свертывают и пептонизируют молоко. При расщеплении белка палочки образуют сероводород, аммиак, индол. На кровяном агаре вокруг колоний наблюдаются зоны гемолиза. Этот вид является одним из наиболее распространенных возбудителей анаэробного разложения белков.
Clostridium sporogenes – палочки размером (0,6–0,9) × (3–7) мкм с закругленными концами, грамположительные, подвижные; быстро образуют эндоспоры, обладающие высокой термоустойчивостью (сохраняют жизнеспособность после выдержки в автоклаве при 120°С в течение 20 мин). Оптимальная температура роста составляет 37°С, но могут расти и при 50°С. Наиболее распространенный вид порчи – образование большего количества газа при расщеплении белков, что может привести к раздуванию упаковки, бомбажу консервов.
Clostridium perfringens – крупная грамположительная палочка размером (5–8) × (1–2) мкм, неподвижная, образующая эндоспоры. Расположение спор субтерминальное или центральное. В организме человека или животного данная палочка способна образовывать капсулу. С. perfringens – анаэроб, быстро растет на питательных средах, особенно с добавлением глюкозы. В глубине МПА колонии имеют вид дисков или плотных комочков ваты. На поверхности кровяного агара образует влажные серовато-зеленые колонии с четкой зоной гемолиза. На среде Вильсона–Блера, содержащей хлорид железа, колонии дискообразные, интенсивно черного цвета с потемнением среды вокруг колонии. Рост микроорганизма в молоке сопровождается образованием губчатого сгустка, «подбрасываемого» к ватной пробке пробирки за счет газообразования. Оптимальная температура роста — 37–39°С. Вегетативные формы Сl. perfringens погибают при температуре 80°С через 30 мин, споры выдерживают кипячение в течение 1–2 ч.
Энтерококки. Это молочнокислые стрептококки кишечного происхождения, лишь недавно перенесенные из рода Streptococcus в новый род – Enterococcus, включающий 16 видов. Типовой вид – Enterococcus faecalis. В настоящее время энтерококки наряду с бактериями группы кишечной палочки считаются санитарно-показательными микроорганизмами.
Enterococcus faecalis – клетки сферической или овальной формы размером (0,6–2,0) × × (0,6–2,5) мкм, располагающиеся парами или короткими цепочками. Грамположительны, эндоспор и капсул не образуют и, как правило, неподвижны. Факультативные анаэробы ферментируют углеводы с образованием L(+)-молочной кислоты. Оптимальная температура роста составляет 37–39°С, температурный диапазон роста — 10–45°С. На МПА энтерококки образуют мелкие, круглые, выпуклые блестящие колонии с ровными краями серовато-голубоватого оттенка. Энтерококки довольно устойчивы к неблагоприятным факторам внешней среды. Они выдерживают кратковременное нагревание при температуре 75–80°С, поэтому занимают большой объем в остаточной микрофлоре пастеризованного молока. Энтерококки обладают протеолитическими ферментами и вызывают появление горького вкуса в молочных продуктах и сырах. За счет выделяемого ими сычужного фермента происходит преждевременное свертывание молока.
Маслянокислые бактерии. Маслянокислые бактерии (Clostridium butyricum и Clostridium tyrobutyricum) относятся к группе сахаролитических клостридий, которые сбраживают сахара с образованием преимущественно масляной и уксусной кислот и газов (СO2 и Н2O). Благодаря своей газообразующей способности маслянокислые бактерии вызывают такие виды порчи молочных продуктов, как «позднее вспучивание» сыров, бомбаж консервов. Присутствие масляной кислоты придает продукту прогорклый вкус.
Clostridium butyricum – палочки размером (0,3–2,0) × (1,5–2,0) мкм с закругленными концами, часто располагающиеся парами или короткими цепочками; капсул не образуют. Клетки со спорами могут иметь форму булавы или теннисной ракетки. В молодых культурах грамположительные и подвижные (перитрихи). В старых культурах подвижность утрачивается и окраска по Граму варьируется. Споры овальные или сферические, их диаметр больше диаметра клетки. Облигатные анаэробы, оксидазо- и каталазоотрицательные. Оптимальная температура роста составляет 30–37°С, температурный диапазон — 10–65°С. Оптимальное значение рН — 7,0–7,4.
Термоустойчивые лактобациллы. В молочных продуктах часто размножаются термоустойчивые молочнокислые палочки, способные выдерживать кратковременную пастеризацию при температуре 85–90°С. Размножаясь в молоке и молочных продуктах, эти бактерии накапливают значительное количество молочной кислоты и вызывают порок «излишне кислый вкус», при котором титруемая кислотность может возрасти до
200–220°Т. Иногда развитие термоустойчивых молочнокислых палочек приводит к появлению в продукте тягучести и «нечистого» вкуса.
Одним из представителей этой группы является Lactobacillus delbrueckii. Данный вид включает три подвида: L. delbrueckii ssp.delbrueckii, L. delbrueckii ssp.bulgaricus, L. delbrueckii ssp.lactis. Палочки с закругленными концами размером (0,5–0,6) × (2–9) мкм, грамположительные, неподвижные; эндоспор и капсул не образуют. В клетках часто наблюдается зернистость. Факультативные анаэробы, ферментируют углеводы с образованием D(–)-молочной кислоты. Оптимальная температура роста — 45–55°С, температурный диапазон — 20–65°С. Каталазо- и цитохромотрицательные.
Мицелиальные грибы. Они способны размножаться на молочных продуктах как при низких температурах, так и при пониженных значениях активности воды aw – от 0,94 до 0,60 (например, Xeromyces bisporus). Присутствие плесени на пищевом продукте делает его непривлекательным для потребителя. Наличие у мицелиальных грибов активных протеолитических и липолитических ферментов приводит к возникновению таких видов порчи, как неприятный запах, прогорклые вкус и запах, изменение структуры продукта. Среди мицелиальных грибов встречаются виды, образующие микотоксины, что представляет опасность для здоровья человека. Чаще всего на молочных продуктах размножается молочная плесень – Geotrichum candidum (синоним Endomyces lactis), образующая белый бархатистый мицелий, гифы которого распадаются на отдельные клетки – оидии, называемые также артроспорами. Geotrichum candidum относится к высшим несовершенным грибам – дейтеромицетам.
Идентификация и подсчет микроорганизмов молока. К бактериологическим методам оценки качества молока относятся:
- стандартное определение численности микроорганизмов посевом на чашках Петри (SPC);
- подсчет колоний с предварительной инкубацией (PIC – Preliminary Incubation Count);
- подсчет колоний после лабораторной пастеризации (LPC);
- подсчет колиформ (Coliform Count).
С помощью SPC-анализа можно получить данные об общей численности аэробных бактерий в молоке. Его сущность состоит в инкубации молока перед проведением анализа при температуре 12,8°С в течение 18 ч. Он используется для индикации бактерий, попавших в молоко с грязного оборудования или из других экзогенных источников.
Теория, лежащая в основе PIC-анализа, заключается в том, что при температурно-временных условиях, которые создаются в ходе анализа, не наблюдается значительного размножения нормальной микробиоты (например, Streptococcus spp.), тогда как микроорганизмы, присутствующие в сыром молоке вследствие плохих санитарно-гигиенических условий (обычно грамотрицательные психротрофы), в этих условиях активно размножаются. Результаты SPC-анализа после предварительной инкубации сравнивают с результатами анализа неинкубированного образца. Это позволяет определить, насколько увеличилась численность бактерий в процессе инкубирования. Если данные PIC-анализа в 3–4 раза превышают данные SPC-анализа, то это считается доказательством недостаточности мер предохранения молока от экзогенной контаминации.
Сущность LPC-анализа состоит в пастеризации сырого молока при температуре 63°С в течение 30 мин. Затем молоко сразу охлаждают до 10°С и производят посев. LPC-анализ применяют в целях подсчета термофильных бактерий, обычно попадающих в сырое молоко с грязного оборудования или от грязных коров.
Подсчет колиформ используется в качестве индикатора фекального загрязнения или контаминации из окружающей среды.
Жидкое молоко после обработки. Как и в микробиологических стандартах по сырому молоку, допустимая численность бактерий в пастеризованном молоке в разных странах различается. Численность микроорганизмов в молоке после пастеризации обычно не превышает 1000 КОЕ/см3. В только что пастеризованном молоке микробиота обычно представлена термофильными организмами, обычными для сырого молока. Через некоторое время в него могут попасть и другие микроорганизмы (постпастеризационные контаминанты), источником которых могут служить технологическое оборудование и окружающая среда. Таким образом, причиной индикации микроорганизмов в молоке, пастеризованном традиционным способом (кратковременной высокотемпературной обработкой), является постпастеризационная контаминация из производственной среды: с грязного производственного оборудования, из воздуха или вследствие контакта с персоналом. Это грамотрицательные микроорганизмы, особенно рода Pseudowonas, а также грамотрицательные Enterobacter, Klebsiella, Alcaligenes, Acinetobacter.
Устранение источников контаминации грамотрицательными постпастеризационными микроорганизмами увеличивает срок годности жидкого молока. При снижении содержания грамотрицательных постпастеризационных коптаминантов следующим по важности фактором возможной контаминации является присутствие и размножение психротрофных спорообразующих термостойких микроорганизмов, в частности штаммов Bacillus spp. и Microbacterium spp. Из рода Bacillus чаще всего выделяются виды В. cereus, В. circulans, В. mycoides и В. licheniformis. Доминирующей микробиотой пастеризованного молока, помимо Bacillus, в котором обнаруживаются и размножаются психротрофы (Pseudomonas spp.), являются бактерии рода Paenibacillus. Эти бактерии сочетают способность выдерживать пастеризацию и размножаться при температурах холодильного хранения, что позволяет считать их микроорганизмами, вызывающими порчу пищевых продуктов.
Представители родов Bacillus и Paenibacillus проникают в молоко из различных источников на протяжении пищевой цепи от ферм до молокоперерабатывающих предприятий. Попавшие в сырое молоко споры бактерий способны выдерживать пастеризацию, прорастать и размножаться в переработанном молочном продукте. Термотолерантные психротрофы могут также контаминировать продукт после пастеризации. Показано, что в продуктах из пастеризованного молока больше штаммов В. cereus, чем в сыром молоке, и это дает основания предполагать, что обсеменение происходит на молокоперерабатывающих предприятиях.
В. cereus и В. mycoides обусловливают «сладкое» свертывание (при низкой кислотности) и появление такого дефекта, как комочки сливок. Штаммы Pseudomonas spp. продуцируют термостабильные внеклеточные липазы и протеазы, которые расщепляют компоненты молока и вызывают его порчу даже после уничтожения в ходе термообработки самих микроорганизмов. Липазы Pseudomonas spp. вызывают появление у молока привкуса прогорклости или горечи. Расщепление протеазами казеина, помимо появления горького вкуса, вызывает свертывание и желирование молока.
Сыры. Присутствие и размножение в молоке дрожжей и плесеней обусловливают появление у него специфического привкуса. В твердых сырах могут размножаться колиформы, Clostridium spp. и плесени. Примером порчи сыра под действием бактерий служит дефект вспучивания при позднем газообразовании, вызванный действием Clostridium tyrobutyricum. Бактерии С. tyrobutyricum попадают в сыр в основном из сырого молока, контаминированного ими вследствие контакта с навозом или ферментированным силосом. В 1 г такого силоса может содержаться более 1 млн спор Clostridium. Порчу мягких сыров могут вызывать психротрофные грамотрицательные палочки (Pseudomonas, Alcaligenes, Achromobacter и Flavobaaerium), ответственные за неприятный запах и вкус продукта вследствие продуцирования ими липолитических и протеолитических ферментов.
Вероятным источником контаминации сырого молока спорами являются экскременты животных. Количество бактерий в навозе дойных коров и кормление их силосом плохого качества находятся в прямой зависимости. Качество кормов и санитарно-гигиенические условия при дойке сильнее всего влияют на степень контаминации сырого молока, в связи с чем их можно считать потенциальными контрольными точками улучшения качества сырого молока и исключения спор клостридий.
Кисломолочные продукты. Причиной микробиологической порчи кисломолочных продуктов являются дрожжи, способные к размножению при температурах холодильного хранения и низких значениях pH. Причиной порчи йогуртов и сметаны обычно являются дрожжи и плесени. Имеет место и бактериальная порча. Порча продукта в результате контаминации дрожжами происходит в основном из-за несоблюдения «правильных» методов производства. В 1 см3 отобранных из торговли образцов йогурта было выделено более 66 дрожжевых клеток. Основными представителями дрожжей, вызывающих порчу, в образцах промышленного йогурта являются Candida lamata, Saccharomyces cerevisiae и Kluyveromyces marxianus.
Основными видами дрожжей в йогуртах признаются Candida lusitariiae, С. kassei, С. rugosa, Kluyveromyces fragilis и Saccharomyces cerevisiae. К дефектам, вызванным наличием дрожжевых клеток в упакованном йогурте, относится выделение газа при сбраживании субстрата дрожжами. К появлению в готовом продукте горького привкуса может приводить присутствие в молоке, используемом в производстве йогурта, большого числа термотолерантных Bacillus.
Протеолитическая активность ферментов термостойких бактерий (Bacillus spp.) может привести к формированию горького привкуса. Колиформы (Escherichia, Enterobacter) и психротрофные микроорганизмы типа штаммов Pseudomonas spp. могут вызвать порчу пахты.
Сливки. В пастеризованных сливках выявляют грамотрицательные бактерии Enterobacteriaceae, Alcaligenes, Acinetobacter и Aeromonas, но преобладают штаммы Pseudomonas spp. Срок годности сливок, как и пастеризованного жидкого молока, сокращается при отсутствии контроля постпастеризационной контаминации продукта психротрофными Pseudomonas и колиформами. К грамположительным микроорганизмам сливок относятся Bacillus spp. и Corynebacterium. Психротрофные микроорганизмы (в частности, псевдомонады и Bacillus cereus) в сливках вызывают такие дефекты, как появление признаков липолитической порчи и горького привкуса в результате протеолиза.
Сливочное масло и спреды с пониженным содержанием жира. Молочные спреды представляют собой смеси молочного жира и растительных масел или сливочное масло пониженной жирности. Спреды являются альтернативой сливочного масла и бывают как с высоким (72–80%), так и с очень низким содержанием жира (менее 30%).
В сливочном масле водная фаза, присутствующая в виде мелких капель, может способствовать размножению микроорганизмов. Спреды наиболее подвержены воздействию микроорганизмов. Важнейшую роль в сохранении качества масла и маложирных спредов, как и других молочных продуктов, играют качество сырого молока и контроль контаминации продукта психротрофными микроорганизмами в процессе его производства, транспортировки и хранения. Фруктовый запах, протеолитическая активность и прогоркание могут быть обусловлены жизнедеятельностью псевдомонад (P. fragi, P. putrefaciens). Прогоркание масла вызывается термоустойчивыми липазами и протеазами, продуцируемыми штаммами Pseudomonas spp., а липолитическая порча масла – жизнедеятельностью бактерий рода Micrococcus (эту порчу можно предотвратить хранением масла при температуре ниже 5°С).
Порчу масла и молочных спредов могут вызывать дрожжи и плесени. К порче сливочного масла могут привести плесени Rhizopus, Geotrichum, Penicillium, Alternaria, Aspergillus и Cladosporium, а также дрожжи Rhodotorula, Cryptococcus и Candida. Они способны испортить продукт даже при хранении в холодильнике.
Микробиологическая безопасность при производстве и переработке молока.
Производство молока. Молоко, поступающее в вымя здоровой коровы, практически стерильно. Поскольку контаминация молока микроорганизмами возможна на ферме, уменьшению ее риска в процессе дойки, охлаждения и хранения молока способствует соблюдение гигиенических мер. Причинами контаминации при дойке и сборе молока являются инфекции вымени, плохая мойка вымени и сосков, а также грязные поверхности оборудования для дойки и охлаждения, контактирующие с молоком.
Молоко от коров, больных гастроэнтеритом, маститом, следует сливать в отдельные емкости, что снижает численность бактериальных и соматических клеток в молоке в общем сборнике. Во избежание попадания бактерий в молоко перед дойкой рекомендуется промывать вымя и соски водой с дезинфицирующим средством. Регулярная мойка оборудования и обязательные санитарно-гигиенические мероприятия (очистка поверхностей оборудования, его дезинфекция и дренаж) снижают численность бактерий и предотвращают образование биопленки. Если ежедневно не удалять грязь и бактерии, это может привести к формированию образующих биопленку бактериальных сообществ, которые намного труднее удалять с поверхностей оборудования, чем отдельные вегетативные бактериальные клетки.
Переработка молока. На молокозаводе источники контаминации молока микроорганизмами – пастеризаторы, оборудование для сборки картонных коробок, насадки установок розлива, упаковочные материалы и воздушная среда предприятия. Во многих странах широко распространена безразборная мойка оборудования, однако при ее ежедневном использовании в труднодоступных для моющих и дезинфицирующих средств местах (муфты, слепые участки и колена труб) бактерии могут выживать. Формирование биопленки в местах контакта оборудования с молоком способствует выживанию бактерий, что может привести к появлению постоянных источников контаминации.
Наличие в производственной среде постпастеризационных контаминантов приводит к быстрой порче продукта, сокращению срока его годности. Срок годности жидкого молока может быть значительно увеличен путем контроля и удаления микроорганизмов, способных контаминировать продукт после пастеризации.
Надежным методом предотвращения повторной контаминации пастеризованного молока является применение «ультрачистого» розлива, который представляет собой фасование обработанного молока в регулируемой газовой среде, что минимизирует возможный контакт продукта с микроорганизмами. Увеличения срока годности молочных продуктов добиваются с помощью повышения температуры пастеризации и исключения или замедления размножения типичных представителей постпастеризационных микроорганизмов порчи. Сроки годности молочных продуктов продляют, применяя асептическую упаковку, что подразумевает стерилизацию собственно упаковки и фасование в нее стерильного продукта в асептических условиях.
Соблюдение температурных режимов. Выдерживание молока и молочных продуктов при температурах, ниже требуемых для размножения микроорганизмов порчи, – важный фактор контроля порчи молока на фермах и в процессе его переработки. Сразу же после сбора молока его охлаждают до 7°С и ниже, что подавляет рост мезофильной и термофильной микробиоты. На современных молочных фермах сырое молоко хранят в охлаждаемых резервуарах и перевозят на молокозавод в охлаждаемых молочных автоцистернах. Эффективные системы охлаждения позволяют реже собирать молоко с удаленных ферм и обеспечивают более продолжительное хранение на них сырого молока. Во время добавления вновь поступившего молока в сборный резервуар температура охлажденного молока в нем не должна превышать 10°С. Для предотвращения повышения температуры молока в сборном резервуаре при добавлении в него более теплого молока к последнему применяют системы предварительного охлаждения.
После пастеризации для сохранения качества молока требуется его быстрое охлаждение. С целью сохранения микробиологической безопасности пастеризованного продукта температура хранения должна быть не выше 4°С. Чем ниже температура хранения, тем длительней срок годности поступающего на реализацию жидкого молока. Температура в местах реализации и у потребителей может варьировать в широких пределах, что, естественно, отражается на сроке годности продукта.
Способы предотвращения порчи молока.
Тепловая обработка. На современном этапе развития технологий ведущую роль в обеспечении безопасности молочных продуктов играет тепловая обработка. Она также позволяет увеличить срок годности молока и производить кисломолочные продукты одинакового качества в результате сокращения численности или уничтожения конкурирующих микроорганизмов.
Наиболее широкое распространение получили следующие способы тепловой обработки сырого молока: пастеризация, ультрапастеризация и ультравысокотемпературная обработка (УВТ-обработка). Санитарная цель пастеризации молока состоит в элиминации всех характерных для молока неспорообразующих патогенных микроорганизмов.
Самым стойким по отношению к высоким температурам неспорообразуюшим микроорганизмом считается Coxiella burnetii. В настоящее время содержание микроорганизмов этого вида в пробах молока, подвергнутого термообработке, количественно определяется лишь косвенными методами (с помощью выявления и оценки концентрации антител у некоторого животного-«хозяина», выпившего это молоко, которым чаще всего выступают морские свинки). Количество С. burnetii измеряют в ИДМС (инфицирующих дозах для морской свинки). ИДМС соответствует наиболее высокой дозировке десятикратно разбавленного молока, вызывающей не менее четырехкратного увеличения титра антител, вырабатываемых организмом морской свинки в качестве реакции на заражение С. burnetii. Наиболее высокое содержание С. burnetii, выявленное в молоке инфицированных коров, составило 10 000 ИДМС. Поэтому для обеспечения достаточной безопасности в качестве минимальных условий пастеризации необходимо подобрать такие режимы, при которых термически уничтожаются С. burneiti в количестве 100 000 ИДМС.
Пастеризация не только уничтожает патогенные виды неспорообразующих бактерий, но и сокращает содержание в молоке микроорганизмов порчи при сохранении его органолептических свойств и пищевой ценности. Существует несколько температурно-временных режимов, допускаемых при температурной обработке молока:
- длительная низкотемпературная пастеризация (Low-Temperature Long-Time, LTLT, или «пастеризация в резервуаре»);
- «пастеризация в резервуаре», которую обычно применяют для молока, предназначенного для изготовления йогуртов и сыров; минимальная температура в этом случае составляет 63°С, а минимальное время – 30 мин;
- минимальные временно-температурные режимы при «пастеризации в резервуаре» (72°С в течение 15 с);
- кратковременная высокотемпературная пастеризация (HTST).
Суть ультрастерилизации состоит в выдержке молока при температуре не менее 138°С в течение не менее 2 с. Цель данного способа – увеличение срока годности продукта по сравнению с традиционной кратковременной высокотемпературной обработкой благодаря более эффективному снижению численности бактерий. УВТ-стерилизация проводится при температурах 140–150°С в течение 1–2 с.
Ультрастерилизация позволяет продлить срок годности продукта при хранении ниже 7°С до 60–90 сут. Срок годности такого молока после вскрытия упаковки не превышает срока годности молока после традиционной пастеризации. Порча молочных продуктов, подвергнутых ультрастерилизации, объясняется в основном ферментативной активностью термостабильных ферментов, продуцированных микроорганизмами еще до стерилизации.
Нагревание продукта до нужной температуры производится либо в пластинчатых теплообменниках (косвенно), либо путем пропускания через продукт острого пара (прямой контакт с теплоносителем). В молочной промышленности чаще применяют второй способ. В дальнейшем молоко фасуют в стерилизованную тару для предотвращения контаминации продукта после стерилизации. УВТ-стерилизованное молоко можно хранить 3–6 мес при комнатной температуре (25°С). К микроорганизмам порчи, выделяемым в УВТ-стерилизованном молоке, относятся термостойкие виды термофильных микроорганизмов, в основном Bacillus stearothermophilus, которые вызывают плоскокислое свертывание.
Эффективность тепловой обработки. Снижение количества микроорганизмов в пастеризованном молоке зависит от качества сырого молока, температуры и продолжительности тепловой обработки, а также от численности и термостойкости присутствующих в молоке микроорганизмов.
Для прекращения размножения микроорганизмов сырое молоко после сбора следует охладить и хранить до тепловой обработки при температуре не выше 7°C. Численность микроорганизмов в сборном молоке до пастеризации не должна превышать нормативных показателей ((3,0–5,0) · 105 КОЕ/см3). Если численность бактерий в сыром молоке превышает ПДК, приведенные в нормативных актах, повышается вероятность их выживания при тепловой обработке. Производители молока должны тщательно контролировать и фиксировать продолжительность и температуры обработки молока. Для отвода любого продукта, не прошедшего соответствующей температурной обработки, разработаны специальные контрольно-измерительные приборы (насосы и расходомеры).
Использование диоксида углерода. Диоксид углерода уже довольно давно применяют для подавления роста микроорганизмов в сыром и пастеризованном молоке. Исследуются возможности его использования и в производстве других молочных продуктов, в частности йогурта и сыра коттедж. Диоксид углерода следует применять для увеличения срока годности продуктов, произведенных из обработанного молока в сочетании с охлаждением, пастеризацией и упаковкой, обладающей высокими барьерными свойствами. При увеличении концентрации СO2 скорость размножения бактерий снижается. В охлажденном сыром молоке СO2 ингибирует размножение психротрофной микробиоты и снижает содержание микробных протеиназ и липаз. Очень важно, чтобы СO2 использовался в концентрации, лежащей ниже порогового уровня восприятия человеком, чтобы он не стимулировал продуцирование токсинов и не способствовал прорастанию спор анаэробных спорообразующих микроорганизмов типа Clostridium botulinum. Добавление СO2 в умеренных концентрациях (9,1–11,9 ммоль) в пастеризованное охлажденное жидкое молоко не приводит к ускорению порчи под воздействием Bacillus cereus или повышению риска заболевания ботулизмом в результате жизнедеятельности Clostridium botulinum. Упаковка в модифицированной газовой среде (МГС) подразумевает применение повышенных концентраций СO2 с использованием других газов или без них. В составе газовых смесей могут использоваться следовые количества СО, N2O и SO2, однако наибольшее распространение в пищевой промышленности получили СO2, азот и кислород.
Микрофильтрация. Альтернативой методам термической обработки (в частности ультрапастеризации) является микрофильтрация, позволяющая сократить численность бактерий в жидком молоке или сыворотке. Микрофильтрация сохраняет вкус продуктов по сравнению с терминированными, поскольку исключается появление пастеризационного и других посторонних привкусов и запахов. Микрофильтрационные мембраны имеют поры размером 0,2–5,0 мкм. Рабочее давление достаточно низкое (0,05–0,20 МПа). Микрофильтры задерживают бактерии размером 1–3 мкм, а также глобулы жира, в связи с чем такая технология более приемлема для обезжиренных молочных продуктов.
Количество микроорганизмов и спор в молоке после микрофильтрации сокращается соответственно на 99,99 и 99,95%. Так как споры психротрофных микроорганизмов рода Bacillus spp. способны выживать при пастеризации, удаление спор микрофильтрацией снижает порчу молочных продуктов. На эффективность удаления микроорганизмов влияют тип используемого фильтровального оборудования, его конструкция и конфигурация. Микрофильтрацию применяют в молочной промышленности для получения питьевого молока с увеличенным сроком годности и молока-сырья для изготовления сыров.
Микрофильтрация молока для изготовления сыров предотвращает вспучивание сыра благодаря удалению из молока-сырья спор Clostridium tyrobutyricum, при этом удаляются также споры других микроорганизмов, которые могут ухудшить качество сыра. Недостаток метода переработки – обезжиривание молока-сырья, хотя обезжиренное молоко после микрофильтрации для достижения желаемого содержания молочного жира в молоке-сырье для производства сыров может быть смешано со сливками.
Современные технологии. К технологиям, повышающим микробиологическое качество и способным увеличить срок годности молочных продуктов, относят микрофильтрацию и применение CO2. Активно изучается возможность применения высокого гидростатического давления и внесения антибиотиков в целях снижения численности микроорганизмов и увеличения срока годности молочных продуктов и сыров.
Суть обработки под давлением состоит в приложении к пищевому продукту равномерного давления 20–1000 МПа, разрушающего мембраны и структуры бактериальной клетки. Для инактивации вегетативных клеток достаточно давления 100–400 МПа. Для уничтожения бактериальных спор понадобится более высокое давление. В качестве альтернативы термообработке молоко-сырье для производства свежих и выдержанных сыров обрабатывали под высоким давлением. Помимо инактивации микроорганизмов жидкого молока, у этой технологии имеется и еще одно преимущество – ее применение практически не сказывается на вкусовых свойствах продукта. Вместе с тем давление может влиять на структурные и функциональные свойства молочного белка, а следовательно, при производстве сыра оно может сказаться на выходе готового продукта, протеолизе и влагоудерживающей способности сыра.
7.4.2. Микробиологическая порча мяса и птицы
Под названием «красное мясо» обычно подразумевают мясо копытных животных (говядину, телятину, свинину и баранину, реже козлятину).
При убое, разделке туш, транспортировке и хранении мясо может быть контаминировано микробиотой из различных источников. Первый и основной источник микробиоты – больное животное, далее идут желудочно-кишечный тракт, шкура животного, руки рабочих, вода, воздух помещений, нож для обескровливания, емкости, транспортировка и хранение, лимфатические узлы.
Если содержимое желудочно-кишечного тракта попадает на поверхность туши, то вместе с ним туша обсеменяется множеством микроорганизмов. Со шкуры микроорганизмы попадают в тушу с ножа для обескровливания во время вскрытия вен у крупных животных и снятия шкур. Часть микрофлоры шкур может переноситься по воздуху и загрязнять поверхность обволошенных туш. Использование перчаток не предотвращает попадания микроорганизмов с одной туши на другую. Нестерильные емкости – первичный источник загрязнения измельченного мяса и мясного фарша. Довольно значимый источник микроорганизмов для убойных животных – циркулирующий воздух.
Микробный состав поверхности туши свидетельствует о ее загрязнениях в процессе убоя и обработки. Грамположительные бактерии с лактобактериями включают и энтерококки. Обнаруживаются также грибы родов: Penicillium, Mucor и Cladosporium.
Продукты из мышечной ткани являются важным для здоровья населения пищевым сырьем с ценными питательными свойствами. Употребление в пищу испорченного или контаминированного микроорганизмами мяса сопряжено с рисками для здоровья: можно заболеть сальмонеллезом, кампилобактериозом, листериозом или геморрагическим колитом.
Мясо крупного рогатого скота и птицы считается испорченным при изменении его внешнего вида, появлении неприятного запаха, слизи. Такие органолептические изменения мяса, проявляющиеся вместе или в отдельности, делают его неприемлемым для употребления. Обнаруживаемое ухудшение органолептических свойств мясопродуктов является результатом разложения тканей с последующим образованием метаболитов, вызванным размножением и катаболической активностью микроорганизмов. Такие органолептические изменения могут быть обнаружены визуально или по появлению неприятного запаха – все зависит от видов колонизирующих микроорганизмов, общих характеристик или типа мяса и птицы, способа их переработки и условий хранения.
Мясо считают продуктом, наиболее подверженным порче, так как его влажная поверхность, богатая питательными веществами, особенно активно колонизируется бактериями порчи, в последующем быстро размножающимися. Поэтому далее текст будет посвящен индикаторам порчи мяса.
Было установлено, что на начальной (наблюдаемой) стадии происходит прикрепление бактериальных клеток к поверхности мяса, названное свободной и обратимой сорбцией. На второй (необратимой) стадии происходит продуцирование бактериями слоя липкого вещества полисахаридной природы – гликокаликса, приводящее к формированию биопленки. Активность присоединения бактерий зависит также от вида микробиоты, уже присутствующей на поверхности мяса, подвижности микроорганизмов, стадии их роста, физических факторов, в том числе структуры поверхности и температуры.
Скорость порчи мяса микроорганизмами находится в зависимости от условий хранения, способствующих размножению бактерий (высокая влажность, температура
от –1 до +25°С). Признаки порчи могут появляться в результате деятельности следующих родов микроорганизмов: Pseudomonas, Moraxella, Psychrobacter, Escherichia, Brochothrix, Aeromonas, Bacillus, Staphylococcus, Citrobacter, Enterobacter, Clostridium, Lactococcus, Lactobacillus, Leuconostoc и Acitietobacter. Доминирующими микроорганизмами порчи в большинстве случаев являются грамотрицательные аэробные палочки (подвижные и неподвижные) и коккобациллы. В исходной популяции бактерий на поверхности мяса, в том числе мяса птицы, могут присутствовать также грамположительные роды микроорганизмов, в частности микрококки и молочнокислые бактерии, которые в анаэробных условиях хранения (в вакуумной упаковке) могут стать доминирующими микроорганизмами порчи.
Известно, что значение pH «свежего мяса» – от 5,1 до 5,9, в нем содержится достаточное количество глюкозы, других углеводов и низкомолекулярных соединений для размножения популяции бактерий.
Быстрее всего размножаются псевдомонады, которые утилизируют глюкозу при температурах холодного хранения. При органолептической порче мяса сначала может ощущаться слабый «молочный» запах, а при исчерпании запаса простых углеводов и других низкомолекулярных соединений появляются характерные запахи: тошнотворно-сладкий запах разложения и гнилостный.
В результате микробиологической порчи продукта из мяса его поверхность из-за размножения бактерий становится липкой. При истощении запасов глюкозы в поверхностном слое мяса бактерии порчи начинают последовательно утилизировать другие субстраты. Метаболизм азотистых соединений и приводит к продуцированию различных дурно пахнущих соединений – аммиака, аминов, диметилсульфида (ДМС) и сероводорода.
Практически все исследования, касающиеся порчи мяса и птицы, за последние примерно 50 лет рассматривают продукты, хранящиеся при низкой температуре.
Обнаружено, что порчу цельномышечной говядины, хранившейся в различных условиях, вызывают следующие виды грибов: Thamnidium, Mucor и Rhizopus, которые проявляются на мясе в виде «нитевидных усиков». Cladosporium образует «черные пятна», Penicillium – зеленую плесень, a Sporotrichum и Chrysosporium – «белые пятна». Большинство грибов не растет на мясе, если температура его хранения ниже 5°С.
Среди родов дрожжей, найденных в говядине, хранившейся при температурах холодильника, можно выделить Candida и Rhodotorulla, причем наиболее распространены в испортившемся говяжьем фарше виды С. lipolytica и С. zeylanoides. Говяжий фарш и мясо для гамбургеров портят исключительно бактерии. Это происходит под действием микроорганизмов, относящихся к родам Pseudomonas, Alcaligenes, Acinetobacter, Moraxella и Aeromonas. Наиболее важную роль в порче мяса играют Pseudomonas и Acinetobacter-Moraxella spp.
Обнаружено, что Pseudomonas spp. – доминирующий вид бактерий при развитии порчи охлажденного мяса и птицы. Род Pseudomonas относится к гамма-подклассу Proteobacteria и включает в себя Р. fluorescence, P. fragi, типовые виды P. aeruginosa и др.
Из 231 полярно жгутиковой аэробной грамотрицательной бактерии, выделенных из говядины, баранины, свинины и колбасного фарша, все палочки – псевдомонады, а из 110 неподвижных организмов 61 представлен Moraxella и 49 – Acinetobacter.
Глубокой порче часто подвергаются бедренные части говяжьих туш и четвертины, обычно около кости, особенно крестцовой. Этот вид порчи часто называют порчей мяса у кости или закисанием. Причина этой порчи – бактерии, относящиеся к родам Clostridium и Enterococcus.
В только что изготовленном говяжьем фарше было обнаружено более 80% микробной популяции, состоящей из хромогенных бактерий, плесеней, дрожжей и спорообразующих бактерий. Однако после порчи были найдены только короткие нехромогенные грамотрицательные палочки. Некоторые бактерии, встречающиеся в свежем мясе, могут расти на культуральных средах при низких температурах. Однако они, очевидно, не могут успешно конкурировать с Pseudomonas и Moraxella-Acinetobacter.
Стейки и ростбифы подвержены поверхностной порче, причем тип заражения (плесневое или бактериальное) зависит от влажности. Нарезанное мясо, хранящееся в холодильнике в условиях высокой влажности, неизменно подвергается бактериальной контаминации. Существенной особенностью такой контаминации является поверхностная слизь, в которой могут находиться болезнетворные микроорганизмы. Относительно высокий ОВП, характерный для высокой влажности, а также низкая температура благоприятствуют росту псевдомонад. Иногда удается различить отдельные бактериальные колонии на поверхности говяжьих кусков, особенно когда уровень контаминации низкий. Слой слизи получается в результате соединения (слияния) поверхностных колоний и в значительной степени является причиной липкой консистенции испорченного мяса.
Запах может быть обнаружен, когда число бактерий достигает log10 7,0 и log10 7,5/см2, далее, когда количество микроорганизмов на поверхности находится в пределах от log10 7,5 до log10 8,0/см2, появляется слизь.
Плесневые грибы начинают доминировать при порче говядины при слишком сухой ее поверхности или после обработки мяса антибактериальными препаратами.
Если условия благоприятствуют росту бактерий, плесень почти никогда не встречается на мясе. Бактерии растут быстрее, чем плесени, и потребляют весь имеющийся на поверхности мяса кислород, который также необходим плесеням.
Первый симптом порчи говяжьего фарша – появление запаха с последующим развитием липкости, которая указывает на присутствие бактериальной слизи. Слой слизи, появляющийся на свежем мясе, птице и морепродуктах по мере их порчи микроорганизмами, является биопленкой.
Порча соесодержащего мясного фарша протекает быстрее, чем порча чистого мясного фарша.
Химические методы выявления порчи мяса предполагают, что, поскольку мясо подвергается порче, некоторые годные для использования вещества потребляются, а некоторый новый продукт или продукты образуются микробиотой порчи. Порча мяса при низкой температуре сопровождается выработкой бесцветных соединений, таких как аммиак, сероводород, индол и амины. Недостатком методик определения порчи мяса является то, что не все микроорганизмы порчи одинаково способны синтезировать указанные вещества. Все физические и прямые бактериологические методы имеют тенденцию показывать очевидное: мясо, которое явно испорчено с точки зрения органолептических характеристик (запах, вид, текстура и вкус), действительно испорчено. Они не позволяют предсказать порчу или срок годности, чему должен в идеале соответствовать тест на свежесть мяса.
Индикаторами порчи мяса можно назвать диамины, кадаверин и путресцин. Образование диаминов происходит следующим образом:
Было исследовано их использование как индикаторов при определении качества говядины, упакованной в вакууме, при температуре хранения 1°С в течение 8 недель. В вакуумно упакованном мясе содержание кадаверина увеличивалось больше, чем содержание путресцина, а в аэробно хранившемся мясе было обнаружено обратное. Уровень кадаверина, измеренный после инкубационного периода, был в 10 раз выше начального уровня при общем числе жизнеспособных микроорганизмов 10/см2, тогда как уровень путресцина изменился незначительно. Таким образом, полученные данные указывают на ценность использования этих диаминов для оценки мяса, упакованного в вакууме. В свежей говядине, свинине и баранине путресцин находится на уровне от 0,4 до 2,3 ppm, кадаверин – от 0,1 до 1,3 ppm. Путресцин – главный диамин, вырабатываемый псевдомонадами, тогда как кадаверин больше вырабатывается бактериями Enterobacteriaceae. Как показывают исследования, содержание путресцина увеличивается с 1,2 до 26,1 ppm в естественно обсемененной говядине, хранившейся при температуре 5°С в течение 4 сут; уровень кадаверина значительно ниже. Согласно другому исследованию уровень обоих диаминов увеличивался одинаково при равных условиях. В одной из работ показано, что изменение уровня гистамина и тирамина в говядине и свинине было слишком незначительным для оценки порчи мяса, но когда порча произошла, уровень путресцина в говядине и кадаверина в свинине сильно изменился.
Показано, что техника определения экстрактивных веществ может быть использована для определения порчи мяса и предсказания времени его хранения в холодильнике. Техника основана на определении объема водного экстракта, высвобожденного гомогенизированной говядиной при фильтрации через бумагу за определенный период времени. Использование этого метода показывает, что говядина хорошего органолептического и микробиологического качества высвобождает больше экстрактивных веществ по сравнению с мясом плохого качества.
Метод ОВЭ (объем выделяемого экстракта) выявляет два аспекта механизма порчи. Во-первых, низкотемпературная порча мяса происходит без значительного разрушения первичных белков, во всяком случае без их полного разрушения. Хотя этот факт был подтвержден анализом суммарного белка в образцах свежего и испорченного мяса, он также подтверждается результатами самого метода; т.е. поскольку мясо подвергается микробной порче, ОВЭ уменьшается, а не увеличивается, как было бы в случае полного гидролиза белков. Во-вторых, обнаруживается увеличение гидратации белков мяса в результате некоторого пока неизвестного механизма, хотя было показано, что к этому имеют отношение аминосахаридные комплексы, вырабатываемые микробиотой порчи. Так как полного разрушения белков не происходит, возникает вопрос: откуда бактерии берут вещества, необходимые для их жизнедеятельности?
При хранении свежего мяса при низкой температуре бактерии, которые могут существовать в таких условиях, начинают размножаться. В свежем мясе с pH около 5,6 содержатся глюкоза и углеводы в количестве, достаточном для поддержания концентрации около 108 кл/см2. Среди гетерогенной микробиоты свежего мяса псевдомонады растут быстрее всего и потребляют при низкой температуре глюкозу и кислород. Brochothrix termosphacta также потребляет глюкозу и глутамат, но из-за низкой скорости роста эти бактерии не могут конкурировать с псевдомонадами. При достижении поверхностной популяцией концентрации, равной 108 кл/см2, источник углеводов иссякает, однако запах на этой стадии еще может не проявиться – все зависит от степени использования свободных аминокислот. После того как все углеводы иссякнут, псевдомонады вместе с другими грамотрицательными психрофилами, такими как Moraxella, Álcaligenes, Aeromonas, Serratia и Pantoea, утилизируют свободные аминокислоты и другие простые азотистые соединения для получения энергии. Acinetobacter spp. утилизирует прежде всего аминокислоты, потом – лактат, а их рост замедляется при pH 5,7 и ниже. В случае с мясом птицы преобразование глюкозы в глутамат дает конкурентное преимущество псевдомонадам.
Различные исследования мясного сока баранины (pH 6,0 и температура 4°С) позволили установить, что P. buorescens более распространен на свежей баранине по сравнению с Р. fragi, но со временем последний становится доминирующим.
Распад аминокислот и подобных соединений (сероводород образуется из серосодержащих аминокислот, NH3 – из различных аминокислот, а индол – из триптофана) приводит к появлению неприятного запаха и вкуса. Было показано, что антигенность солерастворимых белков говядины не разрушается при обычных условиях низкотемпературной порчи.
В начале порчи повышается уровень pH, увеличивается число бактерий и повышается гидратация белков. В говяжьем фарше уровень pH может подняться до уровня испорченного мяса – 8,5 (исходное – 6,5). Фаза снижения роста может быть объяснена исчерпанием усваиваемых большинством микробиоты веществ и накоплением токсичных побочных продуктов бактериального метаболизма. Точный же механизм разрушения белков при низкой температуре исследован недостаточно.
Микробиота порчи красного мяса. В красном мясе чаще обнаруживают грамотрицательные бактерии следующих родов: Acinetobacter, Aeromonas, Alcaligenes, Campylobacter, Escherichia, Moraxella, Micrococcus, Psychrobacter, Pseudomonas. Из грамположительных нередко выявляют представителей родов Brochothrix, Corynebacterium, Enterococcus, Leuconostoc, Staphylococcus. В красном мясе чаще всего встречаются плесневые грибы родов Cladosporium, Geotrichum, Mucor, Rhizopus и дрожжи родов Candida, Torulopsis.
Исследование 255 образцов свинины показало наличие в мясе 247 проб (97%) энтерококков, 54% которых принадлежало виду Enterococcus faecalis, 38% – виду E. faecium.
Измельченное мясо содержит больше микроорганизмов, чем мясо в тушах, полутушах, четвертях. Причинами этого служат следующие факторы.
Мясной фарш готовят из обрезков, полученных от разных кусков. Куски часто берут в руки, на поверхности которых содержится большое количество микробных контаминантов.
Увеличение площади поверхности мяса при разделке на куски способствует росту микробиоты, т.е. развитию микробной порчи.
Волчки для мяса, ножи и тара для хранения на промышленных предприятиях не всегда подвергаются чистке так тщательно, как это необходимо для обеспечения успешного предупреждения развития микробной порчи.
Микробиота порчи свежей птицы. В потрошеной птице число бактерий ниже, чем в цельной. В таких продуктах большинство микроорганизмов сосредоточено на поверхности, поэтому количество бактерий на поверхности тушек имеет большее значение по сравнению с их количеством во внешних слоях и внутри тканей. Исследование куриных тушек на шести различных коммерческих фабриках показало, что начальная обсемененность составляла в среднем log10 3,3 КОЕ/см2. После разделки кур обсемененность увеличилась до log10 3,81, а после упаковки – до log10 4,08. На конвейере на птице обнаруживали
log10 4,76 КОЕ/см2 бактерий.
Реже по сравнению с сальмонеллой в продуктах из индейки находили Campylobacter jejuni. По результатам исследований оплодотворенные яйца индейки и вылупившиеся индюшата не содержали этих микроорганизмов. Через две недели после вылупления индюшат в брудерных птичниках 76% фекальных образцов были обсеменены этими микроорганизмами.
Исследования различных продуктов из птицы показали, что полуфабрикаты из индейки (рулеты) содержат относительно небольшое количество бактерий всех типов. При исследовании 118 образцов готовых продуктов из бройлеров С. perfringens был найден в 2,6% из них. Исследование куриных тушек в Аргентине показало, что 7 из 70 содержали Yersinia spp., включая Y. enterocolitica и Y. frederiksenii (4,3% каждого микроорганизма), и Y. intermedia (1,4%). Все выделенные Y. enterocolitica принадлежали к биогруппе 1А, серотипу 0:5 и фаготипу Хг. В продуктах из птицы часто встречаются энтерококки. Из 227 образцов индейки, исследованных в штате Айова в 2001–2002 гг., 226 содержали эти организмы, причем 60% выделенных бактерий были идентифицированы как E. faecium и 31% – как Е. faecalis. Из 236 образцов кур 234 показали наличие микроорганизмов, из которых 79% принадлежали Е. faecium и 16% – Е. faecalis.
Исследования изменения состава кишечных бактерий на различных этапах холодильной обработки птицы показали, что на тушке до охлаждения число микроорганизмов составляло: logI0 3,17КОЕ/см2 АПК и log10 2,27КОЕ/см2 Enterobacteriaceae. После охлаждения 85% кишечных бактерий было представлено Е. coli, но через 10 сут хранения при 4°С их число уменьшалось до 14%, тогда как число Enterobacter spp. за это же время увеличивалось с 6 до 88%. Другое исследование показало, что Micrococcus spp. был единственным самым изобилующим родом бактерий на домашней птице во время ее обработки. Количество микроорганизмов на образцах кожи с шеи было больше, чем на образцах, связанных с пером, причем как до, так и после ошпарки. Corynebacterium spp. в изобилии обнаруживались в ось-пробах воздуха убойного цеха. При исследовании 1297 тушек бройлеров в 1994–1995 гг. в США в 43% случаев был обнаружен Clostridium perfringens, в 64% – Staphylococcus aureus.
Дрожжи, растущие на тушках бройлеров при температуре 4°С в течение 14 сут, были выделены и идентифицированы, при этом как минимум семь родов были идентифицированы как Candida, за ними следовали Cryptococcus и Ya-rowia.
Микробиота свежей птицы, как показали многочисленные исследования, представлена более чем 25 родами. Преобладающие бактерии, вызывающие процесс низкотемпературной порчи, принадлежат роду Pseudomonas. Исследование куриных тушек показало, что из 5920 видов обнаруженных микроорганизмов псевдомонады составляли 30, Acinetobacter – 22,7, Flavobacterium – 13,9, Corynebacterium – 12,7, Enterobacteriaceae – 8,9%. Из обнаруженных Pseudomonas 61,8% были флуоресцирующими, а 95,2% окисляли глюкозу. Содержание Acinetobacter и других видов бактерий уменьшалось наряду с псевдомонадами.
В случае применения антибиотиков для подавления роста бактерий грибы сильнее всего вызывают порчу птицы. Если применяются антибиотики, то плесень в процессе порчи начинает доминировать. Наиболее важные дрожжи, найденные в птице, относятся к родам Candida, Rhodotorula, Debaryomyces и Yarrowia. Особенность порчи птицы – это появление слизи на поверхности тушки или на разделанных кусках. Внутренняя полость тушки часто является источником кислого запаха. Особенно это актуально для птицы, при разделке которой внутренности оставляются внутри. Причиной порчи являются все упомянутые виды бактерий в дополнение к энтерококкам.
Было обнаружено, что двумя доминирующими родами дрожжей, появляющимися как на свежих, так и на испорченных тушках, были Candida и Debaryomyces spp., тогда как Rhodotorula не была обнаружена на испорченных тушках. Trichosporon spp. отсутствовали на свежих тушках, но были обнаружены в 5% испорченных, тогда как 3% свежих и 11% испорченных тушек содержали Yarrowia. Два наиболее распространенных вида дрожжей, которые обнаруживали на свежей и испорченной продукции, – Candida zelanoides и Debaryomyces hansenii.
Среди бактерий, составляющих биоту свежей птицы, есть микроорганизмы, продуцирующие сильный запах. Shewanella putrefaciens хорошо растет при 5°С и выделяет сильный запах через 7–8 сут при росте на мышечных тканях птицы. Куриная грудка портится по-другому, чем куриная ножка, потому что последняя имеет более высокий pH. При хранении куриных ножек при 2°С в течение 16 сут образуется микробиота, состоящая из 79% псевдомонад, 17% Acinetobacter-Moraxella и 4% S. putrefaciens. Все выделенные в последнем случае культуры продуцируют сульфидоподобные ароматические вещества, H2S, метилмеркаптан и диметилсульфид. Они не имели значения при порче куриных грудок.
При разделке птицы с сохранением внутренностей микроорганизмы проникают через стенки кишечника и попадают во внутренние ткани полости тушки. Состояние мяса птицы, связанное с такой порчей, известно как порча внутренностей.
Во время порчи птицы запах появляется в основном до ослизнения с образованием колоний, которые обнаруживаются при значении log10 КОЕ/см2 ≈ 7,2–8,0. Ослизнение обычно возникает вскоре после появления запаха с количеством микроорганизмов
log10 > 8,0 КОЕ/см2. Первичный рост приурочен к поверхности мяса птицы, ткани же под кожей остаются свободными от микроорганизмов некоторое время. Однако постепенно бактерии проникают глубоко в мышечную ткань, вызывая повышение гидратации мышечных белков, как в говядине.
Существенное ограничение порчи птицы ее поверхностями связано с тем, что внутренние ткани птицы, как правило, стерильны или содержат небольшое количество микроорганизмов, которые не растут при низких температурах. Микробиота порчи ограничивается поверхностью и локализуется там, куда она попала с водой во время обработки и разделки. Поверхность свежего мяса птицы при сохранении влажности может стать местом обитания аэробных бактерий, таких как псевдомонады. Эти микроорганизмы хорошо растут на поверхности, где они образуют колонии, которые впоследствии покрывают всю площадь и вызывают ослизнение (биопленку), характеризующее испорченную птицу.
Таким образом, кожа птицы является лучшим местом роста и размножения микробиоты порчи. В начальной стадии порчи поверхность мяса птицы часто флуоресцирует в ультрафиолетовом свете из-за большого количества флуоресцирующих псевдомонад. Бактерии, вызывающие порчу мяса птицы, можно наблюдать в виде слизи на его поверхности, но еще лучше они видны, если приготовить мазок на предметном стекле. Окраска по Граму не позволяет различать перечисленные микроорганизмы. Для определения микробной активности на поверхности мяса птицы может быть использован тетразолий (2,3,5-трифенилтетразолиумхлорид). Потрошеные тушки опрыскивают этим веществом, при этом в областях высокой микробной активности появляется красная окраска. Эти области включают в себя главным образом поверхности разреза мышц, а также другие поврежденные области, в том числе волосяные сумки. Когда со свежих тушек снимают кожу, мышцы ножек более подвержены микробной порче, чем грудные мышцы, так как у первых значение рН, как правило, составляет 6,3–6,6, а у последних имеет более низкие пределы – 5,7–5,9. Когда порча мяса птицы происходит при 1°С, псевдомонады доминируют, а при температуре 10 и 15°С преобладают кишечные и другие бактерии.
В заключение надо отметить следующее. Мышечные ткани млекопитающих после их смерти обеспечивают необходимыми для роста веществами бактерии, дрожжи и грибы. Адекватное количество элементов, необходимых для роста микроорганизмов, присутствует в свежем мясе в доступной форме. При анализе испорченного мяса и мясопродуктов находят только некоторые роды бактерий, дрожжей и плесеней из многих возможных, причем в большинстве случаев один или несколько найденных родов будут характеризовать порчу данного вида мясного продукта. Разнообразную микробиоту в неиспорченном мясе представляют микроорганизмы, которые присутствуют в естественной окружающей среде рассматриваемого продукта, или контаминанты, занесенные в него во время обработки, упаковки и хранения.
7.4.4. Микробиота порчи рыбы и морепродуктов
Рыба содержит сравнительно высокие количества белков и других азотосодержащих веществ. Природа азотосодержащих веществ специфична для мяса рыбы. Не все азотистые компоненты в рыбе находятся в составе белков. Среди компонентов небелкового азота – свободные аминокислоты, азот летучих оснований типа аммиака и триметиламина, креатин, таурин, бетаины, уриновая кислота, анзерин, карнозин и гистамин.
Бактериальной порче подвержена свежезамороженная рыба; соленая и высушенная рыба с большой вероятностью подвергается порче грибами. Бактериальная микробиота испорченной рыбы состоит в основном из аспорогенных грамотрицательных палочек родов Pseudomonas и Moraxella-Acinetobacter, способных расти при 0 и 1°С. Особо восприимчивыми к порче частями рыбы являются жабры и слизь на внешнем наружном покрове. Слизь состоит из мукополисахаридных веществ, свободных аминокислот, оксида триметиламина, производных пиперидина и других подобных веществ. Ранние признаки органолептической порчи могут быть замечены при исследовании жабр на посторонний запах.
Если не проводить своевременного потрошения рыбы, кишечные бактерии быстро проникают через кишечные стенки в ткани кишечной полости. Этому процессу, как полагают, способствует действие протеолитических ферментов, представленных пищеварительными ферментами рыбы, или бактериальными ферментами кишечной микрофлоры рыбы, или теми и другими вместе. Общее количество микроорганизмов на поверхности рыбы определяют числом микроорганизмов, выраженных на 1 см2. Исследования проводят путем посева на чашках Петри.
Микроорганизмы порчи сначала используют простые вещества, образуя различные летучие дурно пахнущие соединения. В процессе порчи рыбы с образованием триметиламина, аммиака, гистамина, сероводорода, индола и других веществ исчезают оксид триметиламина, креатин, таурин, анзерин и т.п. Мясо рыбы подвергается автолизу быстрее, чем мясо млекопитающих, при общем отсутствии полного протеолиза. Автолиз наряду с микробной порчей, как полагают некоторые исследователи, ускоряет процесс порчи, в частности микробной, а разграничить эти процессы трудно. При детальном изучении причин типичной порчи рыбы установлено, что микробные контаминанты принадлежат к родам Pseudomonas и Acinetobacter-Moraxella.
Согласно исследованиям, 159 штаммов грамотрицательных бактерий, выделенных из испорченной пресноводной рыбы, обсемененной общей аэробной микробиотой в количестве 108 КОЕ/г, 46% микробиоты составляли псевдомонады и 38% – Shewanella spp. Последний микроорганизм производит H2S и восстанавливает триметиламин-N-оксид. Как предполагают, он является основной бактерией, вызывающей порчу рыбы.
При исследовании микрофлоры кожи рыб обнаружены следующие микроорганизмы: Pseudomonas-Alteromonas — 32–60%, Moraxella-Acinetobacter — 18–37%. Начальная микробиота филе сельди представлена S. putrefaciens и псевдомонадами. После порчи при доступе воздуха эти микроорганизмы составили 62–95% микрофлоры. При порче в атмосфере 100% СO2 при 4°С в филе сельди почти полностью доминировали лактобациллы. В филе каменного окуня, хранившегося в атмосфере, состоящей из 80% СO2 и 20% воздуха, при 4°С в течение 21 сут, микробиота на 71–87% состояла из лактобацилл. Исследования психрофильных Enterobacteriaceae, выделенных из упакованного под вакуумом и в атмосфере СO2 лосося холодного копчения, показали, что преобладали виды Pantoea agglomérons и Serratia liquefaciens. Число Enterobacteriaceae, обнаруженных в испорченных изделиях, находилось в диапазоне от 103 до 1,2 · 107/г, но их роль в процессе порчи неясна. В средиземноморском леще, хранившемся в аэробных условиях и в модифицированной атмосфере, в процессе аэробной порчи участвовали два доминирующих вида – Pseudomonas lundensis и P. fluorescens. В испорченной морской рыбе различных видов часто обнаруживают Photobacterium phosphoreum.
Микробиотная порча мяса ракообразных подобна порче мяса рыбы. У ракообразных порча начинается с внешней поверхности. Мышцы ракообразных содержат более 300 мг азота/100 г мяса, что значительно выше, чем у рыбы. Присутствие повышенных количеств свободных аминокислот и азотистых экстрактивных веществ в мясе ракообразных делает их весьма восприимчивыми к быстрому развитию бактерий, вызывающих порчу. Начальная порча мяса ракообразных во многом схожа с таковой мяса рыбы. Микробная порча креветок сопровождается увеличенной гидратацией, свойственной мясу или домашней птице.
Микробиота моллюска находится в прямой зависимости от качества воды, из которой он выловлен, качества промывочных вод и других факторов. В испорченных устрицах обнаружены следующие роды бактерий: Serratia, Pseudomonas, Proteus, Clostridium, Bacillus, Escherichia, Enterobacter, Pseudoalteromonas, Shewanella, Lactobacillus, Flavobacterium и Micrococcus. Поскольку порча развивается и прогрессирует, Pseudomonas и Acinetobacter-Moraxella spp. преобладают наряду с энтерококками, лактобациллами и дрожжами, доминирующими на последней стадии порчи.
Измерение рН, очевидно, – более объективный тест, определяющий порчу устриц и других моллюсков, чем измерение азота летучих оснований.
Хотя рН расценен многими исследователями как лучшая объективная методика определения микробного качества устриц, показано, что определение органолептической характеристики и микробного числа – более надежные показатели микробного качества этих изделий.
7.4.5. Механизм порчи рыбы и морепродуктов
Рыба, как и мясо, ввиду ее анатомического строения и биохимического состава, – скоропортящийся продукт. Расположенный вдоль всего тела кишечник представляет постоянную опасность обсеменения мышечной и других тканей микроорганизмами кишечника. Поверхностная слизь рыбы служит питательной средой для микроорганизмов и способствует последующему обсеменению мышечной ткани.
Рыхлая структура мышц, большое содержание влаги, отсутствие плотной соединительной ткани ускоряют распространение микроорганизмов по телу рыб. Распространению и быстрому размножению микроорганизмов благоприятствует их психрофильность и высокая каталитическая активность. В том числе это касается пищеварительных ферментов кищечника рыбы.
Испорченная рыба выделяет дурно пахнущие вещества: индол, скатол, аммиак, сероводород.
Для длительного хранения рыбу замораживают, сохраняя ее при температуре ниже
–12°С, или солят. В таких условиях рыба практически не подвергается микробиальной порче. Для сохранения икры применяют консерванты.
При исследовании микробной порчи рыбы наблюдается восстановление триметиламин-N-оксида (ТМАО) до триметиламина (ТМА):
ТМАО – вещество, присутствующее только в морской рыбе. В свежепойманной рыбе ТМА содержится в небольших количествах или не содержится вовсе. Поэтому считается, что присутствие ТМА в рыбе имеет микробное происхождение, хотя некоторые виды рыб содержат тканевые ферменты, которые восстанавливают ТМАО до ТМА. Не все бактерии равны по способности восстанавливать ТМАО до ТМА – все зависит от рН.
Методы, используемые для обнаружения ТМА, основаны на его экстракции из рыбы с последующей реакцией с пикриновой кислотой. Для обнаружения ТМА используют газовую хроматографию.
Определение СO2 с использованием инфракрасного СO2-анализатора используется в качестве быстрого метода обнаружения порчи в охлажденной рыбе. Результаты этого нового метода детекции СO2 хорошо коррелируют с данными АПК.
Гистамин, диамины и сумма летучих веществ также используются как индикаторы порчи рыбы. Гистамин производится микробной гистидиндекарбоксилазой из аминокислоты гистидина. Гистамин связан с отравлением рыбой семейства скумбриевых. Кадаверин и путресцин – наиболее важные диамины, рассматриваемые как индикаторы порчи, они используются для рыбы так же, как для мяса и домашней птицы.
Известно, что тирамин производится такими микроорганизмами, как Carnobacterium pise cola и Weissella viridescens, выделенными из упакованной под вакуумом посоленной с добавлением сахара рыбы.
Наиболее важное различие в химическом составе между ракообразным и моллюском – более высокое содержание углеводов в последнем. Например, мясо гребешка содержит 3,4% углеводов, а устрицы – 5,6%, главным образом в виде гликогена. Высокое содержание углеводов в моллюсках является причиной различных видов порчи этих пищевых продуктов.
Гликоген моллюсков утилизируется микроорганизмами порчи. В мясе моллюсков также много азотистых оснований. В их мышечной ткани наблюдается более высокое содержание свободных аспаргиновой и глутаминовой кислот, чем в рыбе.
Контрольные вопросы и задания
- Опишите типы и механизмы микробиологической порчи пищевых продуктов. Дайте определение порче пищевых продуктов.
- Назовите индикаторы порчи пищевых продуктов. Изложите методы идентификации микробиоты порчи: молекулярно-генетические, микроскопические и биосенсорные.
- Поясните сущность индикации и идентификации дрожжей, вызывающих порчу пищевых продуктов.
- Опишите методики определения количества дрожжей в пищевых продуктах.
- Изложите методику идентификации дрожжей, основанную на описании их филогенетических свойств.
- Поясните сущность индикации и идентификации плесеней, вызывающих порчу пищевых продуктов.
- Изложите методы определения количества плесневых грибов в пищевых продуктах: метод посева, метод фильтрации, метод подсчета гифов.
- Раскройте сущность и опишите микроскопический метод идентификации плесеней.
- В чем сущность микробиологической опасности, связанной с порчей пищевых продуктов сапрофитной микробиотой?
- Раскройте механизмы микробиологической порчи молока. Опишите микробиоту порчи молочных продуктов; гнилостные бактерии, аэробные спорообразующие бактерии, аэробные неспорообразующие бактерии, факультативно-анаэробные неспорообразующие бактерии, анаэробные спорообразующие палочки, энтерококки, маслянокислые бактерии, термоустойчивые лактобациллы, мицелиальные грибы.
- Изложите сущность методов оценки качества молока – методов посева, подсчета колоний с предварительной инкубацией, подсчета колоний после лабораторной пастеризации, подсчета колиформ.
- Опишите микрофлору молока после обработки.
- Охарактеризуйте микробиологическую порчу сыров, кисломолочных продуктов, сливок, сливочного масла.
- Изложите технологические приемы получения и переработки молока, используемые для предотвращения его порчи.
- Охарактеризуйте способы термической обработки молока.
- Раскройте сущность новых современных технологий обеззараживания молока.
- Что влияет на численный и видовой состав микробиоты красного мяса и мяса птицы?
- Какие группы и виды микробиоты могут преобладать в мясе при его порче?
- Опишите механизмы порчи мяса микробиотой.
- Каково распространение микробиоты в красном мясе и в мясе птицы?
- Опишите микрофлору порчи мяса.
- Опишите микрофлору порчи птицы.
- Раскройте механизмы порчи сырья и пищевых продуктов микроорганизмами.