Все организмы построены из химических компонентов, и все процессы жизни происходят на основе химических реакций, подчиненных законам термодинамики. Температура действует на скорость химических реакций и является причиной структурной перестройки протеинов, фазовых перемещений жиров, изменения структуры воды. Температурная амплитуда биохимической активности относительно мала в связи со специфическими свойствами биомолекул.
По отношению к температуре среды обитания микроорганизмы делят на мезофильные, психрофильные и термофильные. Деление бактерий на указанные группы довольно условно, так как температурные диапазоны их роста значительно перекрываются (рис. 13.1).
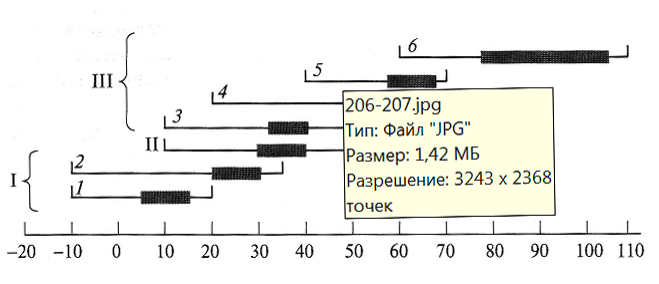
Рис. 13.1. Температурные границы и оптимальные зоны роста прокариот
и основанная на этом их классификация:
I – психрофилы: 1 – облигатные; 2 – факультативные; II – мезофилы; III – термофилы: 3 – термотолерантные; 4 – факультативные; 5 – облигатные; 6 – экстремальные. Жирной линией выделены оптимальные температуры роста
К мезофилам относятся микроорганизмы, у которых оптимальные температуры роста лежат между 30 и 40°С, а температурный диапазон, в котором возможен рост, находится между 10 и 45–50°С. Типичным мезофилом является Е. coli: нижняя граница роста 10°С, верхняя – 49°С, оптимальная температура – 37°С при росте на богатой среде.
Психрофилы и факторы, определяющие возможность роста при низких температурах. Границы адаптивных температур для психрофилов лежат в диапазоне от
–10 до +20°С. Психрофилы делятся на облигатные и факультативные.
Сходство облигатных и факультативных психрофилов состоит в способности к росту при 0°С и минусовых температурах. Термин «психрофильные организмы» в настоящее время применяется в пищевой микробиологии к микроорганизмам, которые растут в области температур от точки замерзания до 20°С при оптимальных значениях температур от 10 до 15°С. Для микроорганизмов, способных расти при 5°С и ниже, был предложен термин «психротрофы» (от лат. psychros – холод и trephein – питаться, развиваться). К психротрофам относят бактерии, растущие при температурах 0–7°С. Поэтому микроорганизмы, вызывающие порчу молочной продукции, мяса, растительного сырья, овощей и фруктов при их хранении в температурных диапазонах 0–5°С, называют психротрофами.
Однако скорость роста у различных групп психротрофов в вышеуказанном диапазоне температур разная, поэтому их разделили на две группы: эврипсихротрофы (от eurypsychrotroph – от eurys – широкий. пространный, размашистый) и стенопсихротрофы. Они отличаются скоростью образования видимых колоний на плотных средах.
Микроорганизмы размножаются при низких температурах, потому что:
- клетки обладают ферментами с низкотемпературной адаптацией;
- в связи с большим количеством ненасыщенных жирных кислот мембраны не замерзают;
- не утрачивается свойство образовывать полисомы при низкой температуре;
- приспособление к пониженной температуре проявляется в изменении состава мембран (в ней повышается содержание ненасыщенных жирных кислот) и синтезе криопротекторов (например, глицерола);
- другой механизм связан с накоплением в клетках больших количеств наиболее важных ферментов, так что даже при неоптимальной температуре их функционирование позволяет клетке поддерживать достаточную активность.
Постоянно обитающие в источниках с низкой температурой микроорганизмы называют психротрофами.
Холодоустойчивость микроорганизмов. Организмы, способные образовывать тепло внутри своего организма с помощью различных физиологических и биохимических механизмов, называют эндотермными (эндотермы), а организмы, температура тела которых полностью зависит от температуры окружающей среды, т.е. определяется внешними источниками тепла, – эктотермными (эктотермы).
Многочисленные наблюдения позволяют утверждать, что при переходе от среды обитания с относительно высокой температурой к среде обитания с низкой температурой эктотермные организмы способны поддерживать свой метаболизм на необходимом для нормальной жизнедеятельности уровне, для чего в процессе эволюции у них сформировались специальные генетико-биохимические механизмы.
Поддержание постоянства метаболизма у эктотермных организмов при смене температуры обитания названо температурной компенсацией. Генетико-биохимическая адаптация эктотермных организмов к изменению температурных условий обитания достигается разными путями: регуляцией экспрессии генов, изменениями функциональной активности ферментов, заменой одних изоферментов другими, изменениями концентрации ферментов в клетках и тканях и подвижностью жидкокристаллического состояния мембран.
Как происходит компенсация температурных влияний у эктотермных организмов? Это осуществляется при помощи качественной или количественной стратегии, т.е. или путем качественного изменения каталитической эффективности самих ферментов, или путем изменений количественного содержания ферментов в клетках. Под каталитической эффективностью фермента понимают меру скорости, с которой одна молекула фермента может превратить субстрат в необходимый для метаболизма продукт.
Патогенные бактерии при выведении из теплокровного организма попадают в окружающую среду, где температура значительно ниже и ее перепад для бактерий может составлять до 30–35°С. С учетом узкого диапазона активности ферментов становится понятным, что в этих изменяющихся условиях один фермент не способен функционировать. Экзотермные организмы могут синтезировать несколько форм ферментов, сходных по функциям, но отличающихся молекулярной массой и приспособленностью к различным температурам. Синтез этих форм может кодироваться разными генными локусами, и тогда они называются изоферментами (изозимами).
Изоферменты, которые способны работать при различных температурах сред обитания, назвали холодовыми и тепловыми вариантами. Этих вариантов может быть от двух и более. Синтезируются они по принципу регуляции экспрессии генов. Различная температура является индуктором депрессии и репрессии операторных локусов, поскольку известно, что репрессоры при различной температуре могут более или менее активно блокировать операторные локусы генов и ослабляют или усиливают их экспрессию. Возможен вариант конформационных изменений фермента, приводящих к переходу фермента в другую форму, адаптированную для работы в холодных условиях. Таким образом, температурная фенотипическая адаптация эктотермов может происходить или вследствие замены одних изоферментов другими, или в результате изменений устойчивости одного и того же фермента.
При изменении температурных условий обитания компенсация может осуществляться за счет изменения концентрации ферментов. Однако для бактерий наиболее целесообразной представляется адаптация к изменениям температуры на изоферментном уровне.
В бактериальной клетке температурозависимые изоферменты всегда находятся в небольших количествах, чтобы немедленно включиться в метаболизм при резких перепадах температуры. А затем под ее индуктивным влиянием синтезируется изофермент, который необходим.
Для каждого фермента существует зона минимума, в которой активность фермента тормозится в разной степени низкой температурой, а реакции, им катализируемые, протекают с меньшей скоростью или останавливаются. Среди многообразия адаптации к температурным условиям среды необходимо отметить пойкилотермию микроорганизмов. Температура микробных тел следует за температурой внешней среды, и микроорганизмы вынуждены периодически впадать в состояние физиологического покоя, что сопровождается повышением устойчивости к неблагоприятным абиотическим факторам.
13.1.1. Термофилы и механизм термофилии
Термофилов делят на четыре подгруппы.
- Термотолерантные микроорганизмы имеют диапазон температуры роста от 10 до 55–60°С, причем оптимальная температура — 35–40°С.
- Факультативные термофилы растут притемпературе 50 и 65°С и способны к размножению при температуре 20°С.
- Облигатные термофилы растут при 70°С, но не размножаются при температуре ниже 40°С.
- Наконец, недавно обнаружены прокариоты, выделенные в подгруппу экстремальных термофилов. Оптимум их роста находится в области 80–105°С, минимальная температура роста – 60°С и выше, максимальная – до 110°С. К экстремальным термофилам относятся организмы из группы архебактерий, не имеющие аналогов среди мезофилов, например представители родов Termoproteus, Pyrococcus, Pirodictium и др.
Появились публикации об обнаружении бактерий, способных расти при температуре воды 250–300° С и давлении 265 атм (при этом давлении вода в жидком состоянии может пребывать до температуры 460°С). Эти бактерии выделены из проб воды, поднятых с глубины 2560 м от поверхности Тихого океана, где предположительно они существуют в горячих струях, выбрасываемых на дне океана так называемыми «черными гейзерами». Давление в районе обнаружения бактерий – около 250 атм, а температура воды может быть выше 350°С. В связи с этим исследователи начинают переоценивать границы условий, при которых способны развиваться прокариоты. Высказывается предположение, что прокариоты могут существовать везде, где есть вода в жидком состоянии и достаточное количество питательных веществ.
Воздействие температуры примерно равной 60°С приводит к гибели вегетативных бактерий в течение 30 мин, а при 80–100°С они гибнут через 1 мин. Температура около и ниже 0°С не обладает повреждающим действием на микроорганизмы.
Микроорганизмы длительно сохраняются при –100°С; некоторые из них десятки лет выживают при температуре жидкого азота (–196°С).
Простейшие и некоторые бактерии (спирохеты, риккетсии и хламидии) менее устойчивы к температурным воздействиям.
Воздействие высоких температур широко используется на практике. Стерилизация (sterilis – бесплодный) объектов проводится методами автоклавирования, кипячения, тиндализации, пастеризации, стерилизации сухим жаром, паром без давления.
Высокая температура вызывает коагуляцию структурных белков и ферментов микроорганизмов.
13.1.2. Использование высоких температур для обеззараживания и сохранения пищевых продуктов
Высокими температурами обычно называют любые температуры выше температур окружающей среды. Для предотвращения порчи пищевых продуктов чаще всего используют методы пастеризации и стерилизации. Использование пастеризации подразумевает температурную дезинтеграцию микроорганизмов или уменьшение количества микроорганизмов порчи.
Например, пастеризация молока проводится при следующих сочетаниях времени и температуры:
- 63°С в течение 30 мин (низкая температура, длительное время обработки (НТДВ));
- 72°С в течение 15 с (ВТКВ);
- 89°С в течение 0,1 с;
- 90°С в течение 0,5 с;
- 94°С в течение 0,1 с;
- 100°С в течение 0,01 с.
Названные способы высокотемпературного воздействия вполне эффективны для дезинтеграции многих устойчивых патогенных бактерий, не способных к спорообразованию.
Внесенные в молоко штаммы Mycobacterium avium subsp. paratuberculosis (от 40 до 100 000 КОЕ/мл) не показали роста колоний после пастеризации молока вышеуказанными способами. Аналогична судьба испытанных дрожжей, мицелиальных грибов, граммотрицательных и многих грамположительных бактерий.
Две группы микроорганизмов способны выдерживать температуры пастеризации молока: терморезистентные (Thermodurics) и термофильные, к которым относятся представители родов Streptococcus и Lactobacillus.
Термофилы к тому же нуждаются в высоких температурах для своего метаболизма. К ним относятся представители родов Bacillus, Clostridium, Alicyclobacillus, Geobacillus и Thermoanaerobacter, которые существенно влияют на сохранение и качество продуктов питания.
Стерильные продукты питания, запечатанные в банках, не содержат живых микроорганизмов или в них не может быть обнаружено обычно применяемыми культуральными методами любое минимальное число живых микроорганизмов.
К методам стерилизации относится использование ультравысоких температур (УВТ). Молоко, подвергнутое УВТ, относится к особого рода продуктам и отличается от пастеризованного молока.
Способ УВТ-обработки предполагает использование высоких температур (в пределах 140–150°С). Достаточное время для надежной стерилизации – несколько секунд.
Рассмотрим влияние некоторых условий хранения продуктов на механизм дезинтеграции микроорганизмов, действуя термическим шоком.
Высушивание микроорганизмов и снижение активности воды повышают резистентность микробиоты и патогенных бактерий к действию термического шока.
Присутствие жиров повышает термическую устойчивость некоторых микроорганизмов. Это явление называют жировой защитой.
Воздействие различных солей, сахаров и рН среды на устойчивость микроорганизмов к термическому шоку не одинаково. Влияние белков, количества микроорганизмов в продукте на их терморезистентность доказано.
Резистентность спор. Резистентность бактериальных эндоспор к термическому шоку имеет большое практическое значение. Причины их высокой резистентности пока не установлены, хотя доказано, что уменьшение содержания влаги в клетке является основной причиной термоустойчивости микроорганизмов. Известны и некоторые другие причины их термоустойчивости.
Ферменты термофильных микроорганизмов могут быть разделены на три группы:
- некоторые ферменты стабильны при температуре их выработки, но для инактивации этих ферментов требуются температуры немного бо́льшие;
- некоторые ферменты инактивируются даже при температуре их выработки в случае отсутствия специфических субстратов;
- некоторые ферменты и белки являются чрезвычайно термоустойчивыми, например, a-амилаза, некоторые протеазы, некоторые ферменты, активирующие аминокислоты, белки бактериальных жгутиков, эстеразы и термолизин.
Ферменты термофилов, которые продуцируются в условиях термофильного роста, проявляют бо́лыпую терморезистентность, чем ферменты мезофилов. Отдельно следует упомянуть об a-амилазе, продуцируемой штаммом бактерий G. stearothermophilus, которая оставалась в активном состоянии даже после нагревания до 70°С в течение 24 ч. Было показано, что оптимум температуры для активности a-амилазы бактерий G. stearothermophilus составляет 82°С, а оптимальное значение рН было равно 6,9. Для сохранения стабильности фермент требует присутствия ионов кальция.
Термостабильность цитоплазматических белков, выделенных из четырех различных термофильных микроорганизмов, была выше, чем у аналогичных белков, изолированных из четырех разных мезофилов.
Следует отметить такую особенность ферментов термофилов, как более высокое содержание гидрофобных аминокислот, чем у аналогичных ферментов мезофилов. Белки, обладающие большей гидрофобностью, проявляют большую степень термоустойчивости.
Некоторые исследователи отметили: не существует доказательств того, что микроорганизмы погибают при нагревании вследствие инактивации белков и других макромолекул, хотя это представление широко распространено. Согласно представлениям этих авторов, гибель микроорганизмов происходит в результате нагревания некоторых больших структур, таких как клеточные мембраны. Образование даже одного отверстия в мембране клетки может привести к вытеканию всего ее внутреннего содержимого и последующей смерти.
Закономерность термической смерти вследствие инактивирования термочувствительных ферментов или термочувствительных рибосом, у которых существует много копий в клетке, не может подчиняться кинетике первого порядка. Предположение о том, что летальные повреждения происходят в результате плавления липидных составляющих клетки или клеточных мембран, является не просто вероятным, а получило подтверждения результатами экспериментов многих исследователей. Клеточная мембрана состоит из липидных слоев, окруженных белками, имеющих разнообразные биологические функции. Следует ожидать, что при разрушении этой структуры наступает повреждение клетки и возможен смертельный исход.
13.1.3. Использование замораживания и низких температур для сохранения пищевых продуктов
Было показано, что температуры ниже точки замерзания губительно действуют на некоторые микроорганизмы. Рассмотрим наиболее характерные последствия воздействия замораживания на некоторые микроорганизмы:
- после замораживания происходит внезапная смерть клеток;
- некоторые клетки отмирают в процессе их хранения в замороженном состоянии;
- при хранении пищевых продуктов при температуре около -2°С микроорганизмы погибают достаточно быстро. Температуры ниже вышеуказанной не приводят к быстрому отмиранию микроорганизмов.
По способности переживать процесс замораживания виды и группы бактериий значительно различаются. Грамположительные кокки проявляют большую устойчивость, чем грамотрицательные. Примером могут служить стафилококк золотистый и сальмонеллы. Высокой степенью резистентности к отрицательным температурам обладают токсины и споры микроорганизмов.
Эксперимент по изучению эффекта воздействия отрицательных температур (замораживание некоторых видов бактерий рода Salmonella при –25,5°С и выдерживание при этой температуре до 300 сут) показал, что число живых клеток снижается, но часть клеток всех испытуемых видов сохраняется.
Сохранение микроорганизмами жизнеспособности в замороженном состоянии зависит от вида, свойств продукта, температуры хранения и других факторов. Замораживание не должно рассматриваться как способ разрушения пищевых микроорганизмов, так как температуры около –20°С лишь незначительно повреждают бактерии в отличие от -10°С.
При замораживании клеток происходят некоторые физические и химические явления в теле микроорганизмов.
При замораживании образуются кристаллы льда, а свободная вода в клетке может быть представлена относительно небольшим числом этих кристаллов. Связанная вода остается в незамороженном состоянии. При замораживании клеток происходит их обезвоживание.
Прямым следствием концентрирования воды в форме кристаллов льда является повышение вязкости клеточного вещества.
Замораживание клеток приводит к высвобождению из цитоплазмы кислорода и углекислого газа, что ведет к репрессии дыхательных реакций и приводит к повышению окислительных активностей в клетках.
Изменяется значение pH клеточного вещества от 0,3 до 2,0.
Наблюдается эффект концентрирования клеточных электролитов, что является следствием концентрирования воды при образовании кристаллов льда.
Замораживание вызывает денатурацию большинства клеточных белков.
Замораживание индуцирует температурный шок у микроорганизмов и вызывает нарушения метаболизма у некоторых из них, таких, например, как Pseudomonas spp.
Это зависит от способности организма переживать обезвоживание, в том числе когда обезвоживание происходит в замораживаемой среде. Бактерии, например, вообще не замораживаются, но почти полностью высушиваются.
Сохранение продуктов питания при низких температурах. Оно основано на существенном снижении интенсивности жизнедеятельности микроорганизмов при температурах немного выше точки замерзания и ее практическом прекращении при температурах ниже точки замерзания. Это обусловлено тем, что скорость ферментативных реакций зависит от температуры. Повышение температуры на каждые 10°С в пределах подходящей для организма области приводит к повышению скорости биологических реакций в два раза.
Температурами замораживания являются те, которые находятся на уровне около -18°С. Некоторые микроорганизмы могут расти в области температур замораживания, но с очень низкой скоростью.
13.2. МЕХАНИЗМЫ ДЕЙСТВИЯ И ИСПОЛЬЗОВАНИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ ДЛЯ СОХРАНЕНИЯ ПИЩЕВЫХ ПРОДУКТОВ
Химические соединения широко используются для предотвращения или задержки порчи пищевых продуктов. Пищевые консерванты не используются для лечения людей и животных. Хотя большинство химических веществ потенциально могут являться пищевыми консервантами, только некоторые из них разрешены к использованию в целях консервации.
Большое количество химических веществ было оценено по эффективности разрушения болезнетворных микроорганизмов на фруктах, овощах и поверхностях мяса. Первичные болезнетворные микроорганизмы – энтерогеморрагические штаммы Е. coli, L. monocytogenes и сальмонеллы. Одна из желаемых целей дезинфекции пищи – это возможность произвести 5-кратное сокращение содержания патогенных микроорганизмов. Помимо применения на поверхностях пищевых продуктов, некоторые из этих химических веществ используются для обработки поверхностей оборудования для переработки и хранения продуктов. Химические вещества, рассмотренные в этом разделе, не добавляют к пище.
Подкисленный хлорид натрия. Производимый подкисленный хлорид натрия (ASC) – продукт, состоящий из лимонной или фосфорной кислоты и NaCl, который используется как спрей (воздействие 5 с), а также в виде раствора (погружение на 5 мин) при концентрациях 1000–1200 ppm.
Антибактериальная активность – продукт диссоциации хлорида, который нарушает или разрушает окислительные связи на поверхности клеточных мембран специфическим способом. Он одобрен в некоторых странах для улучшения качества пищевых продуктов и медикаментов и как дезинфицирующее средство для птицы, поверхностей красного мяса, морепродуктов, некоторых фруктов и овощей, а также некоторых видов обработанного мяса. Он используется перед охлаждением и после него для целых тушек птицы либо тушек, разрубленных на куски. Также он может использоваться для воды или льда. Подкисленный сульфат кальция – родственный препарат.
Электролизуемая оксидированная вода (ЕО). Впервые она была продемонстрирована в России в 1970-х гг. и в дальнейшем в Японии как обладающая антибактериальными свойствами. Этот процесс происходит в специальном устройстве после наполнения водопроводной водой и добавления NaCl. Вода и соль (около 12%) сепарируются мембраной. Когда прикладывается напряжение, продукт, который произведен на катоде, имеет рН ~ 11,4 и окислительно-восстановительный потенциал (ORP) 795 mV, в то же время продукт на аноде имеет рН ~ 2,4–2,6 и ORP ~ 1150 mV. Подкисленная вода содержит небольшое количество свободного С12 (10–80 ppm) и хлорноватистую кислоту и более антибактериальна, чем катодная вода. Летальный эффект ЕО воды, видимо, обусловлен более экстремальным ORP по отношению к другим факторам, хотя некоторые свидетельства указывают на другие составляющие, например, хлорноватистую кислоту. Грамотрицательные бактерии, похоже, более чувствительны, чем грамположительные.
Из многочисленных исследований стало ясно, что ЕО демонстрировала эффект уменьшения патогенных микроорганизмов на 2–5 порядков от их первоначального содержания в свежих продуктах, ростках бобов и т.д. Когда сравнили ее действие на
S. typhimurium и L. monocytogenes в течение 5- и 15-минутного погружения при 4°С, оказалось, что содержание S. typhimurium уменыпилось на пять порядков. Содержание L. monocytogenes уменьшилось на 4 порядка. Кислотная ЕО была наиболее эффективна при 25°С.
При использовании культуральной среды было достигнуто уменьшение на 7–10 порядков содержания смеси пяти штаммов Е. coli 0157:Н7, S. enteritidis и L. monocytogenes после погружения при 4 или 25°С в кислотную воду. После 10-минутного погружения произошла полная инактивация штаммов. Вода в этом исследовании имела рН 2,4–2,6.
Активизированный лактоферрин (ALF, Activin). Лактоферрин – компонент свежего молока, который обладает антибактериальными свойствами, гликопротеин с молекулярной массой приблизительно 80 000. Он содержится также в физиологических жидкостях. Активин – более мощный антибактериальный препарат, чем обычный лактоферрин. Ему присвоен статус GRAS американским Управлением контроля качества пищевых продуктов и медикаментов.
Механизм действия заключается в его способности образовывать внутрикомплексное соединение с Fe2+ наряду с НСO3. Он связывается с клеточной поверхностью и имеет высокое сходство с внешними мембранными белками (ОМР) грамотрицательных бактерий как блокирующее вещество, которое служит препятствием адгезии бактериальных клеток и животных тканей; ингибирует рост и нейтрализует эндотоксины; взаимодействует с нуклеиновыми кислотами и активен против РНК- и ДНК-вирусов; препятствует закреплению болезнетворных микроорганизмов на поверхностях мяса.
Озон (O3). Это газ с высокой антибактериальной активностью – является мощным окислителем (в 1,5 раза более мощный, чем хлор); эффективен как в растворе, так и в газообразной форме. Его получают при помощи генераторов озона. Озон не оставляет остатка после реакции, но его антибактериальная активность блокируется органическими веществами.
Запах озона обнаруживают при его концентрации 0,01 ppm. Пороговая величина при длительном воздействии на человека – 0,1 ppm/день/рабочей недели, но при краткосрочном воздействии – 0,3 ppm в течение 15 мин. Озон нарушает функции проницаемости клеточных мембран микроорганизмов. Он признан безвредным для использования в бутилированной воде и разнообразных свежих пищевых продуктах, но в связи с его сильной способностью к окислению не рекомендуется его применение для красного мяса. Типичная используемая концентрация – 0,1–0,5 ppm, которая эффективна против грамположительных и грамотрицательных бактерий, так же как против вирусов и одноклеточных простейших
Хотя механизм действия SO2 неизвестен, предлагались несколько вариантов, каждый из которых подтвержден экспериментальными данными. Одним из предположений является то, что недиссоциированная сернистая кислота или молекулярный SO2 ответственны за антибактериальную деятельность. В пользу этого предположения говорит факт большей эффективности при низком pH. Было предложено понизить pH определенных пищевых продуктов добавлением кислоты с целью получения большей степени сохранности при использовании SO2. Существовало предположение, что антибактериальное действие обусловлено сильной восстановительной способностью, позволяющей этим соединениям уменьшать парциальное давление кислорода до значения, ниже которого не могут расти аэробные организмы, или прямым воздействием на определенную ферментативную систему. SO2, как считают специалисты, является ферментативным ядом, сдерживающим рост микроорганизмов путем ингибирования основных ферментов. Его использование при сушке пищевых продуктов для ингибирования ферментативного окрашивания основано на этом предположении. Поскольку сульфиты, как известно, действуют на дисульфидые связи, можно предположить, что затронуты определенные основные ферменты и так происходит ингибирование. Сульфиты не препятствуют клеточному транспорту.
Преобладание ионной формы сернистой кислоты зависит от pH среды, причем pH < 3,0 способствует образованию SO2 pH 3,0–3,0 — HSO3 и pH > 6,0 — SO3. SO2 имеет pH 1,76 и 7,2. Соли сернистой кислоты взаимодействуют с различными веществами пищи, включая нуклеотиды, сахар и другие.
На микроорганизмы SO2 воздействует бактериостатично (используется против Acetobacter spp. и молочнокислых бактерий) при низком pH, при концентрации 100–200 ppm эффективен в фруктовых соках и напитках. Самыми чувствительными бактериями оказались восемь серовариантов сальмонелл, которые были ингибированы 15–109 ppm SO2 при pH 7,0; самыми устойчивыми были Serratia liquefaciens, S. marcescens и Hafnia alvei, требующими 185–270 ppm свободного SO2 в бульоне.
Сернистая кислота при 0,2–20 ppm эффективна против некоторых дрожжей, включая Saccharomyces, Pichia и Candida, для Zygosaccharomyces bailii для ингибирования в определенных видах фруктовых напитков при pH 3,1 требовалось до 230 ppm. В действительности дрожжи могут продуцировать SO2 при ферментации сока.
Нитриты и нитраты. Нитрат натрия (NaNO3) и нитрит натрия (NaNO2) используются для различных видов мяса, так как они стабилизируют его красный цвет, ингибируют некоторые виды болезнетворных микроорганизмов и микроорганизмов порчи, а также влияют на его аромат.
И хотя микроорганизмом, имеющим особую чувствительность к нитритному ингибированию, является С. botulinum, состав оценен на антибактериальную активность по отношению к другим организмам.
Антиботулинический эффект состоит в ингибировании вегетативного клеточного роста и предотвращении прорастания и роста спор, которые выдерживают высокотемпературную обработку или копчение. Остальные клостридии также ингибируются. Принимая во внимание, что низкий первоначальный уровень нитрита достаточен для развития цвета и аромата, для проявления антибактериальных эффектов необходимо его значительно более высокое содержание.
Он был признан как консервант рыбы и был достаточно эффективным, но при низком значении pH. Он эффективен против S. aureus при высоких концентрациях, и опять-таки эффективность увеличивается с понижением pH.
Состав неэффективен против энтеробактерий, включая сальмонеллы и молочнокислые бактерии, хотя некоторый эффект отмечен в обработанном и упакованном под вакуумом мясе, благодаря, вероятно, взаимодействию нитрита с другими параметрами окружающей среды.
Также он эффективен против ряда клостридий, включая С. sporogenes и С. perfringens, которые часто используются в лабораторных исследованиях, чтобы оценить антиботулинический потенциал, вследствие использования не только нитритов, но и других ингибиторов, которые могли бы иметь ценность как дополнения к нитритам или другим агентам. Используя среду культуры, в 1967 г. было выявлено, что нитрита требовалось приблизительно в 10 раз больше, чтобы ингибировать клостридии, если они были внесены прежде, чем среда была стерилизована в автоклаве. Было заключено, что нагревание среды с нитритом произвело вещество или агент, приблизительно в 10 раз более эффективный, чем собственно нитрит. Эти агенты известны как фактор Perigo. Существование этого фактора или эффекта некоторыми было подтверждено, а другими подвергнуто сомнению.
Хлорид натрия и сахар. При высоких концентрациях соль оказывает подсушивающее влияние и на пищу, и на микроорганизмы. Соль в воде при концентрациях 0,85–0,90% образует изотонические условия для микроорганизмов. Поскольку количество NaCl и воды равно с обеих сторон мембраны клетки, движение воды через мембрану клетки одинаково в обоих направлениях. Когда микробные клетки суспендированы в 5%-м солевом растворе, в клетках концентрация воды больше, чем снаружи (самая высокая концентрация Н2O там, где низкая концентрация раствора). При диффузии вода перемещается из области высокой концентрации в область низкой концентрации. В этом случае вода быстрее выходит из клеток, чем входит в них. В результате клетка подвергается плазмолизу, что ведет к ингибированию роста и в дальнейшем – к смерти. Это по существу то, что происходит, когда высокие концентрации соли добавляются к свежему мясу с целью его сохранения. И микробные клетки, и клетки мяса подвергаются плазмолизу, приводя к сушке мяса, ингибированию или смерти микробных клеток. Для достижения гипертонических условий должно быть использовано достаточное количество соли. Чем выше концентрация, тем больше проявляются консервирующие и подсушивающие эффекты. В отсутствие охлаждения рыба и мясо могут быть эффективно сохранены солением. Ингибирующие эффекты соли не зависят от рН в отличие от некоторых других химических консервантов. Большинство неморских бактерий может быть ингибировано 20%-й или меньшей концентрацией NaCl, тогда как некоторые плесневые грибы переносят и более высокую концентрацию. Организмы, которые могут расти в присутствии соли и требуют ее высокой концентрации, известны как галофилы; те, которые могут противостоять, но не растут при высоких концентрациях, упоминаются как галотолерантные.
По существу сахар, такой как, например, сахароза, проявляет консервирующий эффект так же, как и соль. Одно из главных отличий состоит в том, что она находится в относительных концентрациях. Сахарозы требуется приблизительно в 6 раз больше, чем NaCl, чтобы достичь той же степени ингибирования.
13.2.3. Антибактериальные препараты непрямого действия
Фенольные антиоксиданты используются в пищевых продуктах, так как была продемонстрирована их антибактериальная активность против широкого спектра микроорганизмов, включая некоторые вирусы, микоплазмы и простейшие.
Бутилгидроксианизол (ВНА) – добавка Е320, бутилгидрокситолуол (ВНТ) – добавка Е321 и TBHQ – добавка Е319. Они ингибируют грамположительные и грамотрицательные бактерии, так же как дрожжи и плесневые грибы при концентрациях в пределах 10–1000 ppm в зависимости от субстрата. ВНА приблизительно в 50 раз менее эффективен по отношению к Bacillus spp. в цыпленке, чем в питательном бульоне. ВНА, ВНТ, TBHQ и эфир галловой кислоты (PG) менее эффективны в свинине, чем в культуральной среде. Используя 16 грамотрицательных и 8 грамположительных видов бактерий в культуральной среде, обнаружили, что грамположительные более восприимчивы, чем граммотрицательные, к ВНА, ВНТ, TBHQ и PG.
Специи и эфирные масла. Механизмы, которыми специи ингибируют микроорганизмы, неясны, но можно предположить, что они отличны для не связанных друг с другом групп специй. Эти механизмы при использовании орегано, розмарина, шалфея и тимьяна могут быть сходными. Сказанное основывается на том, что резистентность некоторых молочнокислых бактерий к одной специи сопровождается резистентностью к другим трем. Из девяти масел специй, тестированных на активность против выделения микотоксинов Aspergillus parasiticus и Fusarium moniliforme, самым эффективным был эвгенол в концентрации 0,25 ppm, сопровождаемый альдегидом коричной кислоты, тимолом и карвакролом, ореганом, маслами шелухи мускатного ореха, содержащими миристин.
Изучение механизма действия эфирных масел (пальмарозы, мяты, тимола монотерпеновых спиртов, фарнезола, орегано, корицы, чабера горного, чайного дерева, тимьяна яйцевидного, гвоздики, эвкалипта, ментола и др.) на микроорганизмы показало, что мишенями действия эфирных масел у Е. coli, М. pneumoniae, Staph. aureus, С. albicans, L. monocytogenes, S. cerevisiae A. fumigates, B. subtilis являются внутренние структуры клетки. При воздействии эфирных масел на микроорганизмы происходят образование нитевидных форм длиной до 25 мкм, округлых форм, нарушение целостности ЦПМ, формирование многослойных мезоподобных структур, повреждение клеточной мембраны. Отмечены нарушения некоторых функций микробных клеток: утечка калия, истощение внутриклеточной АТФ, изменение мембранной проницаемости, полная ингибиция клеточного деления. У подвергнутых действию эфирных масел микроорганизмов происходили изменение метаболизма, окислительного фосфорилирования, разрушение целостности клеток, регистрировалась деградация ЦПМ.
Этаноловый экстракт из 33 специй протестирован на бульоне по отношению к С. botulinum; показано, что экстракт шелухи мускатного ореха дал MIC 31 ppm и был самым эффективным при 33 ppm. Следующими по эффективности были мускатный орех, лавровый лист, белый и черный перец с MIC 125 ppm. Используя масло орегано, тимьяна и сассафраса, обнаружили, что 100 ppm были эффективны по отношению к V. parahaemolyticus в бульоне. Рост и производство афлатоксина Aspergillus parasiticus в бульоне было ингибировано 200–300 ppm корицы и масла гвоздики, 150 ppm альдегида коричной кислоты и 125 ppm эвгенола.
Органические кислоты. Уксусная и молочная кислоты часто используются как консерванты. Нередко они появляются в пищевых продуктах в процессе производства под действием молочнокислых бактерий. Ферментированные продукты (квашеная капуста и ферментированное молоко) изготавливаются ферментативным воздействием различных молочнокислых бактерий, которые производят уксусную, молочную и другие кислоты.
Антибактериальный эффект органических кислот объясняется понижением рН ниже диапазона роста и метаболическим ингибированием недиссоциированными молекулами кислоты. Молочная кислота усиливает проницаемость внешней мембраны грамотрица-тельных бактерий и является потенцирующим средством других антибактериальных препаратов.
Когда Е. coli 0157:Н7 и пять других видов обнаруживаемых в пище патогенных микроорганизмов были выдержаны в 10%-й уксусной кислоте при 30°С в течение 4 сут, на засеянной питательной среде ничего не выросло. Та же концентрация уксусной кислоты уменьшала содержание Е. coli 0157:Н7 на шесть порядков через 1 мин.
Когда два разных вида сальмонеллы были добавлены в масляно-уксусную заправку салата, величина начальной инокуляции составила 5 · 106; S. enteritidis не обнаруживался через 5 мин, S. typhimurium не был обнаружен через 10 мин.
Антибиотики – вторичные метаболиты, продуцируемые микроорганизмами, ингиби-рующие или приводящие к гибели множество микроорганизмов. Большинство антибиотиков синтезируется грибами и бактериями рода Streptomyces и некоторыми Bacillus и Paenibacillus spp. Многие из клинически используемых агентов теперь получают синтетически.
Идея использования химических консервантов, в том числе антибиотиков, в пищевых продуктах крайне непопулярна среди потребителей. Некоторые риски могут ожидаться от использования любой добавки к пище, но риски не должны превышать выгоды. Общее представление состоит в том, что выгода, которая будет получена при использовании антибиотиков в пищевых продуктах, не перевешивает рисков.
Требования, предъявляемые к применению антибиотиков в качестве консервантов, представлены ниже:
- антибиотический агент должен убивать, а не ингибировать микрофлору, и идеально разлагаться в обрабатываемом продукте или разрушаться при приготовлении продуктов, которые требуют тепловой обработки;
- антибиотик не должен инактивироваться компонентами пищи или продуктами микробного метаболизма;
- антибиотик не должен стимулировать появление устойчивых штаммов;
- антибиотик не должен использоваться в пищевых продуктах, если он уже используется терапевтически или как кормовая добавка.
Монензин. Антибиотик был одобрен в качестве кормовой добавки для крупного рогатого скота и используется для компенсации аминокислотной недостаточности у жвачных животных.
Антибиотик ингибирует грамположительные бактерии, поэтому его долгосрочное использование может способствовать изменению состава бактериальной биоты желудочно-кишечного тракта с грам-положительного до грамотрицательного. Монензин – ионофор (нарушает селективную проницаемость мембран клетки).
Тетрациклины. Хлортетрациклин (СТС) и окситетрациклин (ОТС) были одобрены FDA соответственно в 1955 и 1956 гг. На уровне 7 ppm происходило контролирование бактериальной порчи необработанного охлажденного мяса птицы, однако эти утверждения были впоследствии аннулированы. Последующие исследования, проведенные большим количеством ученых во многих странах, установили эффективность СТС и ОТС при замедлении бактериальной порчи не только свежей рыбы и морепродуктов, но и домашней птицы, мяса, овощей, молока и других пищевых продуктов. СТС более эффективен, чем ОТС. Поверхностная обработка охлажденного мяса раствором 7–10 ppm приводит к увеличению срока годности по крайней мере на 3–5 сут и изменению биоты порчи с грамотрицательных бактерий на дрожжи и грибы. Комбинирование СТС с сорбатом для замедления порчи рыбы было эффективным в течение 14 сут. Свежее филе, опущенное в раствор СТС 5 ррm и 1%-й раствор сорбата, показало значительно более низкую обсемененность (в АПК) на поверхности после хранения в вакуумной упаковке при 2°С в течение 14 сут, чем контрольные образцы.
Тетрациклины чувствительны к высокотемпературным и неустойчивым условиям хранения пищевых продуктов, и эти факторы были важны для их использования в производстве пищевых продуктов. Они используются для лечения болезней людей и животных, а также в качестве пищевых добавок в США. Риски, связанные с использованием тетрациклинов как пищевых консервантов в развитых странах, явно перевешивают выгоды.
Субтилин. Этот антибиотик был обнаружен и разработан учеными в Западной региональной лаборатории USDA, его свойства были описаны Dimick и др. Он структурно подобен низину, производится штаммами Bacillus subtilis. Как и низин, он эффективен против грамположительных бактерий, устойчив к кислоте и обладает достаточной резистентностью к высокой температуре, противостоит деструкции при 121°С в течение 30–60 мин. Субтилин эффективен для консервов при концентрации 5–20 ррm, он предотвращает прорастание эндоспор, действуя с точки зрения механизма как низин. Подобно низину он не используется при лечении заболеваний людей и животных и как пищевая добавка. Этот антибиотик может быть столь же эффективным, как низин, хотя на него не обращают пристального внимания с 1950-х гг. Его способ действия, разработка и оценка были рассмотрены выше.
Тилозин. Этот антибиотик – неполиеновый макролид, каковыми являются клинически используемые антибиотики эритромицин, олеандомицин и др. Он обладает бо́льшим ингибирующим действием, чем низин или субтилин. Изучено возможное применение этого антибиотика в консервах. Когда в зерна, содержащие споры, был добавлен 1 ррm тилозина, продукт не портился в течение 30 сут при инкубации при 54°С.
В отличие от низина, субтилина и натамицина тилозин используется в кормах животных и при лечении некоторых заболеваний домашней птицы. Как макролид он более эффективен против грамположительных бактерий. Он ингибирует синтез белка, связываясь с 50S-субъединицами рибосом, и показывает, по крайней мере частичную, гибридрезистентность с эритромицином.
13.2.5. Противогрибковые средства для фруктов
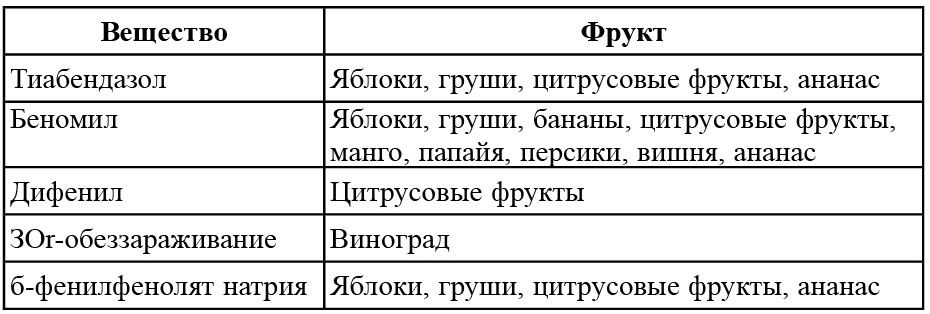
Перечисленные в табл. 13.1 вещества применяются для обработки фруктов после сбора урожая для контролирования роста грибов. Беномил наносится однородно по всей поверхности фруктов. Он используется в концентрации 0,5–1,0 г/л. Он может проникать через поверхность некоторых овощей и используется во всем мире, чтобы контролировать гниль верхушек и антракноз бананов, а также гниение плодов цитрусовых. Беномил более эффективен, чем тиабендазол, и проникает внутрь более легко. И беномил, и тиабендазол эффективны при контролировании сухой гнили, вызванной Fusarium spp. Для предотвращения распространения Botrytis на винограде для долгосрочного хранения используется SO2. Типичная начальная обработка состоит из 20-минутного применения 1%-го раствора и приблизительно 0,25%-го при последующих обработках (использование SO2 в других пищевых продуктах обсуждалось выше).
Экстракт Trichoderma sp. (6-пентил-a-пирон, 6-РАР) – эффективный ингибитор штаммов Botrytis и Armillaria, которые разрушают фрукты киви в Новой Зеландии.
Таблица 13.1
Некоторые химические вещества, применяемые для контроля
грибной порчи свежих фруктов
(Eckert, J.W., 1979)
Оксиды этилена и пропилена наряду с этил- и метилформиатом (НСООС2Н5 и НСООСН3 соответственно) рассматриваются вместе в этом разделе из-за сходного способа действия. Структурные формулы оксидов следующие:
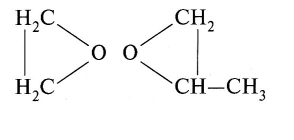
Газы используются как фумиганты в пищевой промышленности. Ими обрабатывают сухие плоды, орехи, специи и т.д., прежде всего как противогрибковыми составами.
Этиленоксид – алкилирующий агент. Предполагается, что его антибактериальная деятельность связана с этой активностью следующим образом. В присутствии лабильных атомов Н нестабильное трехчленное кольцо этиленоксида распадается. Атом Н присоединяется к кислороду, образуя этилгидроксильный радикал СН2СН2ОН, который присоединяется к органической молекуле вместо атома Н. Этилгидроксильная группа блокирует реактивные группы микробных белков, таким образом приводя к ингибиро-ванию метаболических процессов. Представляется, что этиленоксид влияет на эндоспоры С. botulinum путем алкилирования гуанина и аденина.
Этиленоксид используется как газообразный стерилизатор для гибких и полужестких контейнеров, используемых для асептической упаковки обработанных пищевых продуктов. Весь газ рассеивается из контейнеров после их удаления из камер обработки. Его действие ненамного более эффективно против вегетативных клеток, чем против эндоспор, как это может быть отмечено по значениям D.
Хитозаны. Хитозаны – катионоактивные полисахариды, производимые из хитина кислотным или ферментативным гидролизом; это деацетилированные производные хитина. Последний может быть получен под действием хитозаназ. О-карбометилированный хитозан водорастворим и обладает более широким антибактериальным спектром, чем некоторые другие вещества. Хитозаны разнообразны по размеру молекул, имеют молекулярную массу от 30 до более 1000. Доказано, что эти вещества более эффективны против грамположительных, чем грамотрицательных бактерий. Они исследуются как антибактериальные вещества для использования в упаковочных пленках (биологически активная упаковка). Поликатионоактивные хитозаны связываются с отрицательно заряженными бактериальными клетками и, оказывая олигодинамическое действие на бактерии, влияют на их мембранные и транспортные функции.
Этанол. Гидроксид пентагидродикарбония присутствует в экстрактах специй и оказывает сохраняющий эффект благодаря своим осушающим и денатурирующим свойствам. Пары этанола могут быть размещены в пустотах упаковки. Доказано, что эти пары могут быть эффективными против некоторых бактерий и грибов. Показано, что этанол повышает чувствительность L. monocytogenes к низким значениям рН, органическим кислотам и осмотическому давлению. Эти эффекты могут проявляться при его 5%-й концентрации. Этанол изменяет мембранную проходимость и таким образом делает клетки более восприимчивыми к определенным агентам. Споры, обработанные этанолом, не прорастали как в питательном растворе, так и непитательном растворе; они не восстанавливались после обработки лизоцимом.
Полиаминокислоты. По крайней мере две аминокислоты катионоактивных полимеров проявили ингибирующие свойства к множеству обнаруживаемых в пище бактерий и грибов и обладают минимальной токсичностью. Очевидно, что они действуют путем влияния на активность клеточных мембран. Эти аминокислоты имеют статус GRAS.
Полилизин эпсилон, производимый в Японии, как было установлено, при концентрации 5 ppm ингибирует некоторые грамположительные бактерии. Он водорастворим, эффективен в широком диапазоне рН, разрушается до лизина протеазами.
13.2.7. Биологический контроль микробиоты
Биоконтроль связывают с защитой пищи с помощью молочнокислых бактерий, бактериоцинов, лейкинов, бактериофагов и «защитных культур».
Это использование одного или более организмов для ингибирования или контроля других организмов. Для контроля можно использовать живой организм или он может быть осуществлен агентами (как при использовании бактериоцинов).
Антагонизм бактерий. Это общее ингибирование или разрушение одного микроорганизма другими видами той же среды обитания. Антагонизм молочнокислых микроорганизмов – четкий пример микробного подавления. Есть другие, менее явные, пути, в результате которых происходят ингибирования. Примеры антагонизма бактерий в пищевых продуктах были отмечены и рассмотрены в конце ХIХ в. Ученые заметили, что естественная биота замороженных пирогов ингибировала инокулируемые клетки Staphylococcus aureus, E. coli и S. typhiniurium. Была выявлена репрессия приблизительно 105/г S. aureus в пирогах с нормальной биотой. Обнаружена неспособность имеющихся в пище болезнетворных микроорганизмов к росту в свежем говяжьем фарше с биотой в концентрации приблизительно 105/г. Начиная с ранних исследований демонстрировался антагонизм нормальной биоты пищи против L. monocytogenes и патогенных штаммов Е. coli. Хорошо установлен подавляющий эффект достаточно развитой аэробной бактериальной биоты против роста Clostridium botulinum в свежем мясе, как и подавление дрожжей и грибов бактериальной биотой свежего мясного фарша.
Несмотря на непонятные механизмы антагонизма бактерий, некоторые наблюдения достойны внимания. Для проявления антагонизма, во-первых, необходимо, чтобы фоновая биота содержала больше жизнеспособных клеток, чем инокулируется клеток организма, который будет ингибирован. Во-вторых, антагонистическая биота в общем случае не гомогенна, и роль, которую играют отдельные виды, неясна. Исследователи выдвинули следующие объяснения антагонизма бактерий: борьба за источники питания; конкуренция за участки присоединения/адгезии; неблагоприятное изменение окружающей среды и комбинация этих факторов.
Антагонизм обычно проявляется при АПК 106 клеток/г. Образование биопленки и возникновение значимого кворума играют пока неизвестную роль в этом явлении.
Молочнокислый антагонизм. Явление молочнокислого ингибирования, или разрушения, связанное как с пищевым отравлением, так и с организмами порчи пищи, наблюдается в течение более чем 80 лет. Точные механизмы его все еще неясны. Среди идентифицированных факторов – производство антибиотиков, Н2O2, диацетила и бактериоцинов в дополнение к падению рН и истощению питательных веществ. Таким образом, молочнокислый антагонизм – пример микробного антагонизма.
«Защитные культуры» относятся к микроорганизмам, которые могут быть найдены или добавлены к пищевому продукту, чтобы его сохранить/защитить. Организмы, участвующие в молочнокислом антагонизме, соответствуют определению защитных культур. Среди свойств, которыми последние должны обладать, следующие:
- они не должны представлять риск для здоровья;
- должны обеспечивать благоприятное воздействие на продукт;
- не иметь отрицательного воздействия на потребительские свойства;
- служить «индикаторами» при условиях злоупотребления.
Молочнокислые бактерии составляют наибольшую и самую важную группу, которая подпадает под эту категорию.
Для примера можно привести результаты одного исследования. Эффективность пяти молочнокислых бактерий, используемых для контроля L. monocytogenes в пастеризованном молоке, была оценена путем инокулирования патогенного микроорганизма в количестве 104 КОЕ/мл с инкубацией при 30°С. Используемыми молочнокислыми бактериями были Lactococcus lactis, Leuconostoc cre-moris, Lactobacillus plantarum, L. delbrueckii subsp. bulgaricus и Streptococcus salivarious subsp. thermophilus. Ингибирование на
89–100% было достигнуто при рН 4,17–4,21 и 30 или 37°С. В ряде других исследований продемонстрирована эффективность различных молочнокислых бактерий как ингибиторов обнаруживаемых в мясе и мясных нарезках патогенных микроорганизмов. Мясная стартовая культура Pediococcus acidilactici вызвала сокращение на 2,3 порядка количества Е. coli 0157:Н7, L. monocytogenes и Staphylococcus aureus в течение ферментации салями после 24 ч по сравнению с сокращением на 1,3 порядка в контрольных образцах.
Низин. Некоторые штаммы Lactococcus lactis производят полипептид низин – антибиотик, прототип образующихся в пище бактериоцинов. Низин используют для предотвращения порчи швейцарского сыра микроорганизмами Clostridium butyricum. Низин эффективен против грамположительных бактерий, прежде всего спорообразующих, и неэффективен против грибов и грамотрицательных бактерий. Enterococcus faecalis – одна из самых устойчивых к нему грамположительных бактерий.
Низин нетоксичен; производится естественным путем штаммами Lactococcus lactis; устойчив к высоким температурам и стабильно сохраняется; разрушается пищеварительными ферментами; не имеет вкуса и запаха; имеет узкий спектр антибактериальной активности.
Бактериофаги как агенты биоконтроля. Литические фаги, специфичные для конкретных видов и штаммов бактерий, как известно, являются эффективными в разрушении клеток их хозяина, что является основой метода фаготипирования. Возникает вопрос, могут ли фаги разрушить клетки хозяина в среде пищевых продуктов. Предотвращают ли пищевые субстраты фаговую атаку на клетки хозяина, и если нет, то какие факторы предотвращают лизис клетки?
Показано, что фаги лизируют клетки хозяина, извлеченные из рыбы, мяса и молока. Существуют более ранние исследования использования фагов и бактерий в бульоне и вытяжках из мяса. В исследовании были использованы стейки с Pseudomonas sp., предварительно изолированные от испорченной говядины, и гомологический фаг в количестве 108 бляшкоообразующих единиц/мл, добавление 108 бляшкообразующих единиц/мл которого увеличило срок хранения стейка с 1,6 до 2,9 сут. В целом при обработке фагами потребительские свойства продуктов были улучшены.
Показано, что фаги уменьшают количество обнаруживаемых в пище патогенных микроорганизмов, таких как L. monocytogenes, на поверхности созревших сыров, а также Е. coli 0157:Н7 и сальмонелл на свежей домашней птице. Колифаги используются для свежей домашней птицы, так как, очевидно, они уменьшают число жизнеспособных Е. coli. Фаги представляют проблемы для стартовых культур молочной и мясной промышленности, вызывая лизис одного или более стартовых штаммов, приводя к дефектной ферментации. Достоверность влияния бактериальных вирусов на сокращение порчи и количества пищевых отравлений пищевыми продуктами требует более подробного исследования.
13.3. ВЛИЯНИЕ ДЕГИДРАТАЦИИ НА МИКРООРГАНИЗМЫ И СОХРАНЕНИЕ ПИЩЕВЫХ ПРОДУКТОВ С ПОМОЩЬЮ ВЫСУШИВАНИЯ
Дегидратация и предотвращение воздействия на микроорганизмы основано на том, что для поддержания функциональной активности микроорганизмам и ферментам необходимо наличие воды. При дегидратации необходимо стремиться к снижению содержания влаги до той точки, при которой ингибируется активность микроорганизмов, вызывающих порчу и пищевые отравления. Пищевые продукты, содержащие не более 25% влаги и имеющие значение активности воды (aw) в пределах от 0,0 до 0,60, относятся к обезвоженным, высушенным продуктам или продуктам с низким содержанием влаги (НСВ). Пищевые продукты, полученные методом замораживания-высушивания, также относятся к этой категории пищи. К другой категории продуктов, пригодных для длительного хранения, относятся те, у которых содержание влаги в пределах от 15 до 50% и которые имеют значения активности воды (aw) в пределах от 0,60 до 0,85. Такие пищевые продукты называются продуктами со средним содержанием влаги (ПСВ).
Бактерии для своего роста требуют относительно высоких уровней влажности; у дрожжей эти требования ниже, а у микроскопических грибов – еще ниже. Бактериям для роста требуются значения aw выше 0,90, поэтому эти виды микроорганизмов не играют роли в порче высушенных пищевых продуктов. Уровни значений aw связаны со стабильностью и сохранностью высушенных пищевых продуктов и с вероятностью их порчи. При aw = 0,80–0,85 в порче продуктов питания участвуют разнообразные микроскопические грибы, процесс длится одну-две недели, а при aw = 0,75 порча замедляется. Порча пищевых продуктов значительно замедляется и может вовсе не происходить в течение очень длительного периода хранения при aw = 0,70. При aw = 0,65 способными к росту оказываются лишь весьма редкие виды микроорганизмов, и вероятнее всего, порча продуктов питания в таких условиях не будет происходить как минимум в течение двух лет (табл. 13.2).
Таблица 13.2
Минимальные значения aw для микроорганизмов пищевых продуктов
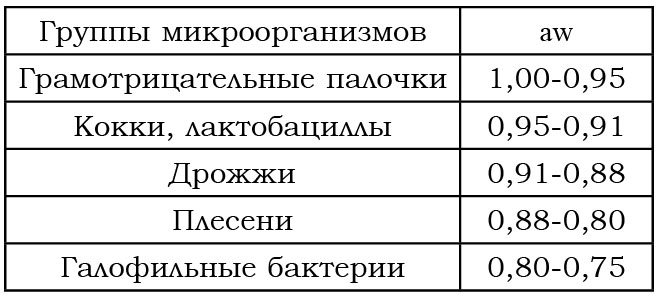
Наибольшие проблемы при хранении высушенных продуктов питания представляет группа микроорганизмов, в которую входят в основном микроскопические грибы. Наибольшими способностями выживать и расти в области низких значений активности воды обладает группа штаммов гриба Aspergillus glaucus. Обнаружено, что доминирующими в процессе порчи как высушенного, так и содержащего много влаги чернослива являются грибы видов Aspergillus glaucus и Xeromyces bisporus. Алейроспоры гриба Xeromyces bisporus, например, были способны прорастать из спор в течение 120 сут даже при aw = 0,605.
Метод замораживания-высушивания является одним из наилучших из всех известных способов сохранения микроорганизмов в жизнеспособном состоянии. После завершения этого процесса клетки могут оставаться жизнеспособными неопределенно долго. При исследовании жизнеспособности 277 культур бактерий, дрожжей и микроскопических грибов, которые были лиофилизированы и хранились в этом состоянии в течение 21 года, обнаружено, что только три культуры не смогли восстановиться после регидратации.
Показано, что быстро замораживаемые пищевые продукты демонстрируют лучшее качество и более приемлемы, чем медленно замораживаемые. Образование очень мелких кристаллов льда при быстром замораживании вызывает меньшие механические повреждения структуры пищевых продуктов, чем при медленном замораживании. После оттаивания в быстро замороженных пищевых продуктах остается больше воды и они демонстрируют характеристики, более близкие к показателям свежих продуктов, чем в медленно замороженных пищевых продуктах.
Вода в белковых пищевых продуктах может быть разделена на две группы: замораживаемая и незамораживаемая. Было определено, что незамораживаемой (связанной) является вода, которая остается не замерзшей при температуре ниже –30°С. Удаление замораживаемой воды осуществляется в процессе первой фазы высушивания. Во время этой фазы происходит удаление от 40 до 95% общего содержания влаги. В последнюю очередь удаляется, как правило, связанная вода. Ее часть может быть удалена в ходе всего процесса высушивания.
Уровень влажности в конечных пищевых продуктах, продуктах, обработанных методом замораживания-высушивания, составляет, как правило, около 2–8% и имеет показатель активности воды (aw) в пределах от 0,1 до 0,25.
Метод замораживания-высушивания является, как правило, более предпочтительным, чем метод высокотемпературного высушивания в вакууме.
Было сделано предположение, что хорошим показателем стабильности хранения высушенных продуктов питания является критическое содержание воды. Этот показатель отражает содержание воды, которое не должно быть превышено для предотвращения роста микроскопических грибов.
В случае использования метода замораживания-высушивания уровень влажности снижается до 2%. Отмечено, что столь низкий уровень влажности является, видимо, излишне жестким для некоторых продуктов питания, которые вполне успешно могут храниться и при большем содержании влаги без излишних расходов на достижение более низких значений критического содержания воды для пищевых продуктов.
В процессе высушивания пищевых продуктов некоторые микроорганизмы подвергаются разрушению, эндоспоры бактерий, тем не менее, при этом выживают. Кроме того, в таких условиях способны выживать дрожжи, микроскопические грибы, а также и многие грамположительные и грамотрицательные бактерии. Исследованиями бактерий куриного мяса, подвергавшегося процедуре замораживания-высушивания и последующей регидратации при комнатной температуре, удалось установить, что в этих условиях около 32% от исходной микрофлоры восстанавливается и способно к росту. Эти исследователи показали, что бактерии Staphylococcus aureus, которые добавлялись до проведения процедуры замораживания-высушивания, могут выживать в таких условиях. Кроме того, было установлено, что некоторые паразиты, которые могут содержаться в продуктах питания, такие, например, как Trichinella spiralis, способны к выживанию в условиях процесса высушивания.
Целью дегидратации является снижение содержания жизнеспособной микробиоты до значений не более 100 000 м. т./г при общем чашечном подсчете. Колиформных бактерий в высушенных пищевых продуктах быть не должно. Недопустимо присутствие других организмов, вызывающих порчу продуктов, за возможным исключением, касающимся небольшого количества бактерий Clostridium perfringens.
Стресс или гибель микроорганизмов в результате дегидратации может быть следствием денатурации компонентов микробных тел, в результате испарения «связанной» воды и/или рекристализации солей или гидратов из эвтектических растворов. Наибольшая скорость процесса отмирания микроорганизмов при дегидратации пищевых продуктов отмечается на ранней стадии высушивания. Сообщалось, что молодые культуры микроорганизмов более чувствительны к высушиванию, чем старые.
Пищевые продукты средней влажности (ПСВ). ПСВ характеризуются значениями влажности от 15 до 20% и значениями активности воды (aw) 0,60–0,85. Пищевые продукты с такой влажностью пригодны к длительному хранению при температуре окружающей среды в течение разных периодов времени. Импульс производству ПСВ был дан в начале 1960-х гг. с развитием рынка собачьих консервов. Производство подобных продуктов для потребления людей развивается уже в течение многих лет. Сказанное относится к традиционным ПСВ, которые следует отличать от новых ПСВ. Традиционные пищевые продукты имеют пониженные значения aw, что достигается извлечением воды путем десорбции, адсорбции, внесения добавок, таких как соли или сахара. Современные ПСВ характеризуются значениями aw в пределах от 0,60 до 0,85, а также использованием таких добавок, как глицерин, двухатомные спирты, сорбит и сахароза, влагоудерживающие вещества и фунгистатики – сорбаты и эфиры бензойной кислоты.
Принципы приготовления пищевых ПСВ. Бактерии Staphylococcus aureus имеют особую важность для здравоохранения. Они способны расти при аw = 0,86. Поэтому технология приготовления пищевых ПСВ должна быть разработана таким образом, чтобы содержание влаги было в пределах от 15 до 50%; при этом aw должно быть доведено до величины ниже 0,86 после применения влагоудерживающих веществ. Должны быть также добавлены антигрибковые агенты, необходимые для ингибирования роста довольно большого числа различных дрожжей и микроскопических грибков, о которых известно, что они способны расти при aw > 0,70. Стабильность при хранении таких пищевых продуктов дополнительно можно повысить посредством снижения рН,
Микробиологическая безопасность пищевых продуктов средней влажности. Значения aw в пищевых ПСВ делает мало вероятным размножение в них граммотрицательных бактерий. Это касается и большинства грамположительных бактерий, за исключением кокков, некоторых спорообразующих микроорганизмов и молочнокислых бактерий. Помимо ингибирующего воздействия низких значений, в пищевых ПСВ антимикробной активностью обладает также сочетание таких факторов, как рН, окислительно-восстановительный потенциал (Eh), консерванты (включая некоторые увлажнители), конкурирующие представители микрофлоры, низкие температуры хранения, а также различные способы высокотемпературной обработки, включая пастеризацию, применяемые в процессе приготовления пищевых ПСВ.
Изменения показателей жизнеспособности культуры бактерий Staphylococcus aureus в высушенных при 25°С с глицерином свиных кубиках иллюстрируют следующие закономерности:
- в случае приготовления продукта методом десорбции и при aw = 0,88 количество жизнеспособных бактерий остается постоянным в течение приблизительно 15 сут, а затем немного повышается;
- в случае приготовления продукта методом адсорбции, при том же значении aw количество жизнеспособных бактерий медленно снижается (бактерии погибают) в течение первых трех недель, затем темпы отмирания бактерий значительно повышаются;
- при всех значениях aw < 0,88 микроорганизмы погибают. Однако скорость отмирания микроорганизмов значительно выше при aw = 0,73, чем при более высоких значениях.
В отношении эффекта термической гибели бактерий в системе ПСВ было показано, что терморезистентность микроорганизмов повышается в случае понижения значений aw, а их устойчивость зависит от компонентов, применяемых при контроле aw.
Можно избежать роста микроскопических грибов в ПСВ, если сделать вполне стабильной активность воды (aw) до значений в области 0,7, но в этом случае будут получены высушенные продукты. Большое количество различных видов микроскопических грибов способно к росту в области значений aw ~ 0,8. Показано, что из семи различных химических ингибиторов, используемых поодиночке или в комбинации друг с другом для ингибирования роста таких микроскопических грибов, как Aspergillus niger и Aspergillus glaucus, предварительно инокулируемых в продукты, пропиленгликоль оказался единственным достаточно эффективным при его добавлении.
Хранение ПСВ в правильно подобранных условиях влажности является основным фактором в предотвращении роста микроскопических грибов и в общем для стабильности хранения.
Взаимообмен водой пищевых продуктов и влажного воздуха происходит до уравновешивания парциального давления при данной температуре с парциальным давлением воды во влажном воздухе. Таким образом, значение равновесной относительной влажности является прямым измерением того, как будет вести себя влага на пищевых продуктах – сорбироваться или десорбироваться.
13.4. ИСПОЛЬЗОВАНИЕ РАДИАЦИОННОГО ИЗЛУЧЕНИЯ
В 1929 г. был получен патент на использование радиации как средства сохранения или защиты пищевых продуктов от микроорганизмов. После Второй мировой войны на этот метод обратили серьезное внимание. Применение этого метода в полном объеме вызывало сомнения микробиологов и других ученых, занимающихся продуктами питания.
Радиация – это эмиссия и распространение энергии через вакуум или среду. Основной тип радиации, которым пользуются при сохранении пищи, – электромагнитный. Электромагнитный спектр разделен относительно по значимости излучения в сохранении пищи следующим образом: микроволновые, ультрафиолетовые УФ-лучи, Х-лучи (рентгеновские) и гамма-лучи.
Наиболее эффективные излучения, используемые для сохранения пищи, – ионизирующая радиация, излучения с длиной волны 200 нм или меньше, например, альфа-частицы, бета-, гамма- и Х-лучи. Они содержат достаточно энергии, чтобы ионизировать молекулы на своем пути. Они разрушают микроорганизмы, не повышая температуру продукта, поэтому процесс называют «холодной стерилизацией».
Рассматривая радиацию, необходимо пояснить несколько используемых понятий. Рентген – единица измерения, используемая для того, чтобы выразить дозу облучения Х- или гамма-лучами. Миллирентген равен 1/1000 рентгена. Кюри – количество радиоактивного вещества, в котором происходит 3,7 · 1010 радиоактивных распадов за 1 с (1 г чистого радия обладает радиоактивностью 1 Кюри). Беккерель (Бк) – один распад в 1 с. Рад – единица, эквивалентная поглощению 100 эргов/г вещества. Килорад (крад) равен
1000 рад, а мегарад (Мрад) равен 1 млн рад. Новая единица поглощенной дозы — Грей
(1 Гр = 100 рад = 11 Дж/кг; 1 кГр = 10 рад). Один электрон-вольт равен энергии, которая необходима для переноса электрона в электрическом поле между точками с разницей потенциалов 1 В. МэВ равен 1 млн электрон-вольт. Рад и эВ — единицы измерения интенсивности излучения.
13.4.1. Механизм действия излучений на микроорганизмы
Ультрафиолетовый свет. Наиболее эффективная длина его волны равна приблизительно 260 нм. Он поглощается белками и нуклеиновыми кислотами, фотохимические изменения которых могут привести к гибели клетки. Механизм гибели бактериальной клетки в результате воздействия УФ-лучей — возникновение летальных мутаций в результате действия на нуклеиновые кислоты клетки. УФ-свет иногда используется для обработки поверхности выпеченных кексов с цукатами и орехами и подобных продуктов перед упаковыванием.
Бета-лучи, гамма-лучи, Х-лучи, микроволны. Бета-лучи – потоки электронов, испускаемых радиоактивными веществами. Катодные лучи – то же самое, за исключением того, что они испускаются катодом вакуумной трубки. Эти лучи обладают плохой проникающей способностью.
Гамма-лучи – электромагнитные излучения, испускаемые возбужденными ядрами таких элементов, как Со и Сs. Это самая дешевая форма радиации, используемой для сохранения пищи, потому что исходные элементы — побочные продукты атомного распада или продукты радиоактивных отходов. У гамма-лучей превосходная проникающая способность в отличие от бета-лучей. Со имеет период полураспада ~ 5 лет; период полураспада Сs — ~ 30 лет.
Х-лучи возникают при бомбардировке ядер тяжелых металлов ускоренными электронами (катодными лучами) в вакуумной трубке. В остальном они по существу представляют собой то же самое, что и гамма-лучи.
Микроволновая энергия. При помещении электрически нейтральных продуктов в электромагнитное поле заряженные асимметричные молекулы сначала двигаются в одном направлении, а затем в другом. Во время этого процесса каждая асимметричная молекула пытается приспособиться к быстро изменяющемуся полю переменного тока. Поскольку молекулы колеблются около своих осей, пытаясь двигаться к положительному и отрицательному полюсам, создается межмолекулярное трение, приводящее к нагреву.
Природа радиационной устойчивости микроорганизмов. Пока неясно, почему некоторые микроорганизмы являются устойчивыми к радиации. Чрезвычайную устойчивость дейнококков к высушиванию связывают с радиорезистентностью.
Радиолиз воды вызывает образование свободных радикалов. Организмы, не устойчивые к радиации, не способны противостоять окисляющему действию радикалов. Химические вещества, которые содержат SН-группы, зачастую обладают радиопротекторными свойствами, но какую роль они играют, если таковая вообще имеется в чрезвычайно устойчивых бактериях, все еще неясно.
Отличие радиоустойчивого вида микроорганизмов D. radiodurans – наличие четырех геномов, т. е. четырех копий собственной хромосомы.
Активно делящиеся клетки могут содержать 4—10 копий. Можно предположить, что дополнительная ДНК поврежденной радиацией клетки синтезирует новый геном.
Два наиболее широко используемых метода облучения продуктов: гамма-излучение от Со или Сs и использование электронных лучей линейных акселераторов.
Гамма-излучение обладает преимуществом, потому что Со и Сs являются относительно недорогими побочными продуктами атомного распада. В радиационной камере, использующей эти элементы, радиоактивный материал помещают наверх элеватора, который поднимается вверх при эксплуатации и опускается вниз под воду, если не используется.
Материалы, которые предстоит облучить, для получения желательной дозы помещают вокруг радиоактивного источника на определенном расстоянии. Как только камеру покидает весь персонал, источник устанавливается на место, и гамма-лучи облучают продукты. Облучение при желательных температурах достигается путем помещения образцов в изотермические контейнеры с регулируемой температурой или камеру со стенами из бетона и свинца. Недостаток использования радиоактивных материалов состоит в том, что изотопный источник испускает лучи во всех направлениях и не может быть «включен» или «выключен» по желанию.
Радаппертизация, радисидация и радуризация продуктов. Радаппертизация – эквивалент радиационной стерилизации или «промышленной стерильности» в консервной промышленности. Типичные уровни облучения — 30–40 кГр. Термин происходит от фамилии изобретателя метода тепловой стерилизации пищевых продуктов в герметичной таре (консервов) француза Николя Франсуа Аппера.
Радисидация – подобие пастеризации, например молока. Приводит к выборочному подавлению жизнеспособных неспорообразующих патогенов большинства типов, кроме вирусов, так, чтобы ни один не был обнаружен любыми стандартными методами. Типичными дозами радиации в этом процессе являются 2,5–10 кГр.
Радуризацию можно считать эквивалентом пастеризации. Она способствует повышенному сохранению качества пищи за счет существенного сокращения числа жизнеспособных не образующих спор патогенов с помощью радиации. Обычные дозы радиации для свежего мяса, домашней птицы, морепродуктов, фруктов, овощей и зерна хлебных злаков – 0,75–2,5 кГр.
13.5. ИСПОЛЬЗОВАНИЕ МОДИФИЦИРОВАННОЙ АТМОСФЕРЫ
Вакуумная упаковка. Воздух извлекается из газонепроницаемых пакетов, после чего пакет запечатывается, что уменьшает остаточное давление воздуха от обычного (1 бар) до 0,3–0,4 бар. При этом определенное количество O2 удаляется. По мере хранения упакованного под вакуумом продукта происходит увеличение содержания СO2 в результате дыхания ткани и микробного дыхания, при котором потребляется O2 и выделяется СO2. Содержание СO2 может увеличиться на 10–20% в течение 4 ч, а в конечном счете концентрация может достигнуть 30% в результате дыхательной активности аэробной микробиоты.
Метод, подходящий для мясного сырья, состоит из простого выдавливания воздуха, что ведет к замедлению роста аэробных микроорганизмов порчи. Вакуумная упаковка минимизирует усадку продукта и задерживает окисление жиров и их обесцвечивание. Барьерные свойства некоторых пластмасс, используемых для упаковывания пищевых продуктов под вакуумом, для СO2 всегда выше, чем для O2, приблизительно в 2–5 раз.
Упаковка в модифицированной атмосфере (МАР). Модифицированная атмосфера – гипербарический процесс, который заключается в создании состава атмосферы упаковки за счет заполнения смесями из СO2, N2, и/или O2. Исходная концентрация газа не может быть изменена в течение хранения. Существует два типа МАР, отличающихся концентрацией O2, СO2 и N2.
Равновесно-модифицированная атмосфера. Упаковывание в равновесно-модифицированную атмосферу (ЕМА) осуществляется путем помещения в газопроницаемую упаковку или запечатывания упаковки без изменения среды. ЕМА используется для упаковывания свежих фруктов и овощей.
Контролируемое атмосферное упаковывание или хранение (САР, CAS). Контролируемое атмосферное упаковывание или хранение можно считать одним из видов MAP. При использовании MAP составы газов могут изменяться в процессе хранения, при применении САР составы остаются неизменными в течение продолжительного периода хранения. САР требует использования многослойных материалов на основе алюминиевой фольги или стеклянных контейнеров, так как однослойная пластиковая пленка не полностью непроницаема для газов.
СO2 блокирует метаболизм Pseudomonas aeruginosa и предположительно влияет на ферментативное декарбоксилирование. СO2 влияет на проницаемость мембран клетки, что показано в исследованиях по прорастанию эндоспор Clostridium sporogenes и С. perfringens. Растворяясь в жидкости, СO2 образует угольную кислоту, которая вызывает нарушение клеточной проницаемости бактерий.
Вакуумная упаковка, MAP и CAS прошли успешные испытания и широко используются в пищевой промышленности.
Основное влияние СO2 на микроорганизмы. При длительном воздействии 10% и более СO2 проявляется следующее.
- Ингибирующая активность СO2 проявляется в обратной зависимости от температуры инкубации или хранения. Это происходит благодаря большей растворимости СO2 в воде при низких температурах по сравнению с высокими. При 1 атм и 20°С 100 мл воды поглотят 88 мл СO2, но только 36 мл при 60°С. Для свежего мяса 20-процентная концентрация СO2 является идеальной. Более высокая концентрация может использоваться для морепродуктов. Для поддержания красного цвета мяса перед обработкой СO2 можно выдерживать его в угарном газе (СО) или хранить в смеси СO2 + O2 в отношении 20 : 80.
- Ингибирование усиливается при уменьшении pH.
- Более чувствительны к действию СO2 грамотрицательные бактерии, наиболее чувствительны – псевдомонады, самые резистентные – клостридии.
СO2, находясь под давлением, обладает значительно большим антибактериальным эффектом, чем в отсутствие давления.
Свежее и обработанное мясо. Срок хранения красного мяса может быть увеличен до
2 мес, если упаковать его в смеси 75% O2 + 25% СO2 и хранить при –1°С.
Как следует из результатов многочисленных исследований, низкотемпературное хранение свежего мяса под вакуумом или в условиях MAP вполне эффективно, что в значительной степени является результатом жизнедеятельности молочнокислых и некоторых других бактерий на свежем мясе. При низких температурах нормальная микробиота предотвращает рост патогенных микроорганизмов за счет понижения рН, конкуренции за O2, возможного синтеза антибактериальных веществ и других факторов.
Морепродукты. В 1933 г. в Англии впервые показано предохраняющее влияние СO2 на рыбу. Использовался состав, состоящий из 80% СO2 и воздуха. При этом содержание микроорганизмов на 1 см2 через 14 сут выдержки при 35°С составляло ~ 6,00 log10/cм2 по сравнению с контрольными образцами, где их содержание было более 10,5 Iog10/см2. Для рыбы следует использовать высокие концентрации СO2, так как она содержит меньше миоглобина.
13.5.2. Микробиологическая безопасность пищи, упакованной в режиме MAP
Clostridium Botulinum. Пищевые продукты, подвергнутые упаковыванию в режиме MAP, должны обладать одним или несколькими из следующих антиботулинических свойств:
- иметь активность воды (aw) < 0,93;
- иметь рН < 4,6;
- быть обработанными NaCl или NO2;
- содержать высокие уровни неболезнетворных микроорганизмов (для сырого мяса, домашней птицы, и т.п.);
- сохраняться в замороженном состоянии;
- иметь определенный срок хранения (например, < 10 сут).
Оценку опасности появления ботулизма при режиме MAP провели в исследовании на пяти видах овощей (салата, капусты, брокколи, моркови и зеленых бобов). Овощи инокулировали смесью спор Clostridium botulinum и хранили в упаковке при 4, 12 и 21°С. В капусте, моркови и бобах не было найдено ни одного токсина при 40°С в течение 50 сут. Токсин был обнаружен во всем объеме брокколи при 21°С.
Listeria monocytogenes. В опыте на свежей говядине с рН 5,47, которая была упакована под вакуумом и инкубирована при 4°С в течение 56 сут, содержание одного штамма увеличилось на 2,3 логарифмических порядка (с 4,25 до 6,53) после 35 сут, содержание другого увеличилось на 1,8 логарифмических порядка после 35 сут, а содержание третьего осталось неизменным после 56 сут. В опыте на говядине с более высоким рН (6,14) через 28 сут значительно увеличилось содержание трех штаммов L. monocytogenes, а содержание четвертого штамма не увеличилось.
Исследование L. monocytogenes на предмет роста и выживания в упакованном под вакуумом говяжьем фарше (начальное значение рН 5,4), инокулированном Lactobacillus alimentarius, показало, что при 2°С количество L. monocytogenes уменьшилось за счет антилистерийного действия лактобацилл благодаря биосинтезу молочной кислоты.
Критическими параметрами для L. monocytogenes в упакованной под вакуумом говядине являются температура хранения, рН и вид мышечной ткани, постность или жирность. Микроорганизм растет более экстенсивно на жирной, чем на постной говядине, а фоновая микробиота не имеет влияния на его рост.
Согласно результатам проведенных в Австралии исследований Listeria spp. на упакованном под вакуумом обработанном мясе, бывшем в розничной продаже, листерии были найдены в 93 из 175 образцов, при этом L. monocytogenes была найдена в 78 из этих 93 образцов. Бактерии были обнаружены в основном на говяжьей солонине и ветчине, на двух образцах говяжьей солонины их содержание было > 104 КОЕ/г.
В одном из исследований роста L. monocytogenes и Yersinia enterocolitica на приготовленной домашней птице, упакованной в режиме MAP, продукт хранился в смеси СO2 + N2, в соотношении 44 : 56 при 3,5; 6,5 и 10°С в течение 5 недель. При указанных условиях испытания естественная микробиота не оказывала влияния на рост, и оба микроорганизма росли.
Предварительно очищенный картофель был инокулирован L. monocytogenes и упакован под вакуумом в низкопроницаемую упаковку. При 4°С не произошло роста микроорганизма в течение 21 сут, но при 15°С его количество выросло на 7 log]0/r в течение 12 сут.
В опыте упаковывания болонской колбасы под вакуумом задержка роста Clostridium perfringens произошла в результате жизнедеятельности микробиоты. Исследование выживаемости Campylobacter jejuni на говяжьем фарше при давлении 4 атм показало, что не отмечено различий в количественном составе С. jejuni. Мясо было обсеменено 105 КОЕ/г С. jejuni и хранилось в среде, состоявшей из 5% O2 + 10% СO2 + 85% N2, 80% СO2 + 20% N2, под вакуумом и в чистом азоте при 4°С в течение 2 недель. В условиях хранения травмированных высокой температурой и нативных клеток Aeromonas hydrophila при 5°С в течение 22 сут в атмосфере 100% N2 или 100% СO2 содержание обоих штаммов уменьшилось.
Токсин, продуцируемый типом Е, не был обнаружен ни в одном из пакетов с речными раками, инокулированными 103 КОЕ С. botulinum типа Е, упакованными под вакуумом в низкопроницаемую упаковку и хранившимися при 4 и 10°С в течение 30 сут.
Контрольные вопросы и задания
- Раскройте механизмы существования микроорганизмов при высоких и низких температурах.
- В чем отличительные особенности психротрофов и психрофилов?
- Охарактеризуйте использование высоких температур для обеззараживания и сохранения пищевых продуктов.
- Охарактеризуйте использование замораживания и низких температур для сохранения пищевых продуктов.
- Как воздействует замораживание на микроорганизмы?
- Раскройте технологии сохранения продуктов питания при низких температурах.
- Опишите механизмы действия и использования химических веществ для сохранения пищевых продуктов: дезинфектантов, консервантов, антибактериальных препаратов непрямого действия, антибиотиков, противогрибковых средств для фруктов, других консервантов.
- Как осуществляют биологический контроль микробиоты при использовании химических веществ?
- Опишите механизмы действия дегидратации на микроорганизмы
- Как обеспечивают микробиологическую безопасность пищевых продуктов средней влажности?
- Раскройте механизм действия излучений на микроорганизмы.
- Опишите применение радиации в обеспечении микробиологической безопасности пищевых продуктов.
- Изложите механизм действия модифицированной атмосферы на микроорганизмы.
- Охарактеризуйте уровень микробиологической безопасности пищи, упакованной в режиме MAP.

