В пивоваренном производстве микробиологическому контролю подлежат:
- ячмень, солод, несоложенные материалы;
- вода;
- дрожжи семенные и чистая культура дрожжей (ЧКД);
- сусло;
- бродящее пиво;
- готовое пиво до и после фильтрации;
- пиво до и после пастеризации;
- упакованное готовое пиво в день розлива и через 10 дней хранения;
- смывы и мазки для определения качества мойки и дезинфекции;
- тара;
- укупорочные материалы;
- технологическое оборудование, коммуникации, моющие реагенты;
- воздух производственных помещений и воздух, подаваемый на аэрацию сусла, углекислый газ.
Для каждого анализа разрабатывается и устанавливается своя программа отбора проб:
- точка отбора;
- объем пробы;
- периодичность отбора;
- показатели и методы анализа;
- допустимое количество микроорганизмов.
При отборе проб для микробиологического анализа необходимо соблюдение условий, исключающих вторичную контаминацию посторонними микроорганизмами. Отбор проб следует проводить только в стерильные емкости и непосредственно перед анализом. В случае необходимости исследуемые пробы хранят в холодильнике не более 2 ч.
Отбор проб из закрытых емкостей:
- слить определенное количество среды, открыв кран и затем закрыв его;
- промыть спиртом отверстие крана снаружи и внутри;
- обработать пламенем;
- промыть спиртом отвод (колено трубы) или спираль (при высоком внутреннем давлении танка) и привинтить;
- обработать пламенем;
- снова слить определенное количество среды, открыв и закрыв кран;
- открыть пробную бутылку и под воздействием пламени взять пробу;
- закрыть пробную бутылку под воздействием пламени на горлышко и затворный конус;
- закрыть пробный кран.
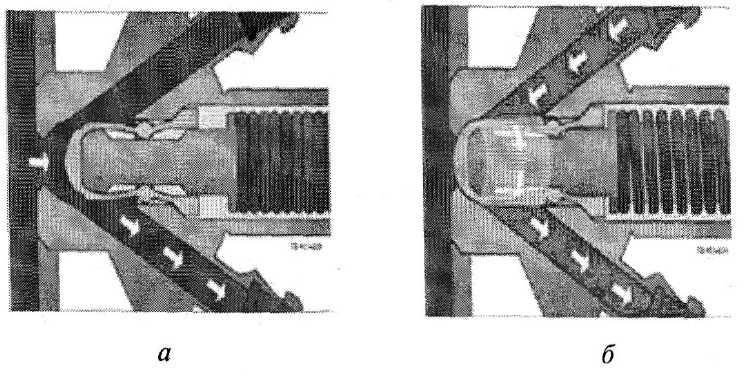
Правила пользования микробиологическим клапаном «Кеофитт» для отбора проб:
- Микробиологический кран «Кеофитт» имеет два выхода (рис. 18), которые должны быть закрыты плотно надевающимися металлическими или резиновыми заглушками.
- Краны должны быть постоянно залиты спиртом.
- Для отбора проб из крана необходимо иметь емкость с 70%-ным раствором спирта.
Рис. 18. Асептический пробоотборный клапан «Кеофитт»
Принцип действия клапана «Кеофитт» представлен на рис. 19.
Рис. 19. Принцип действия клапана «Кеофитт»: а – клапан открыт, отбор пробы; б – клапан закрыт, стерилизация
Порядок отбора проб:
- Снять пробку с нижнего выхода крана.
- Осторожно открыть кран, вращая барашек только в соответствующем направлении.
- Первую порцию жидкости слить, чтобы удалить спирт из крана.
- Произвести отбор пробы в стерильную емкость.
- Кран закрыть, промыть его спиртом, чтобы смыть остатки пива.
- Надеть заглушку на нижний выход крана, через верхний выход залить спиртом весь свободный объем крана.
- Закрыть заглушкой верхний выход, чтобы спирт не испарялся.
Отбор проб с поверхностей предназначен: для контроля мойки внутренних стен чанов и емкостей (танков); внутренних стен трубопроводов, шлангов; внешних поверхностей блоков розлива и укупорщиков бутылок; внешних поверхностей блоков розлива в кеги; шпунтованных соединений; зон за снятыми уплотнениями; при смене танков и т.д.
Отбор проб с мелких твердых тел (например, с кронен-пробок) производят путем их погружения в стерильную емкость с широким горлышком, заполняют стерильным физиологическим раствором (0,9%-ный раствор хлорида натрия). Затем этот физраствор подвергается мембранной фильтрации.
Отбор проб с бутылок и кег производят следующим образом. Для контроля качества мойки бутылки и кеги промываются стерильным физиологическим раствором, в который может добавляться Твин 80 (1 см3/дм3). Затем промывная жидкость подвергается мембранной фильтрации.
Ячмень, солод, хмель, ферменты, сахарный сироп, несоложенные материалы. Пиво должно вырабатываться из доброкачественного сырья, отвечающего требованиям ГОСТов, ТУ. Зерно считается хорошим, если общее количество колониеобразующих единиц составляет менее 105/г. Ячмень, солод и несоложенные материалы анализируются при поступлении на завод и по мере необходимости.
Сахароза, сахарный сироп, мальтозная патока часто являются источником мезофильных аэробных бактерий, диких дрожжей, спор мицелиальных грибов, а также слизеобразующих бактерий p. Leuconostoc. Содержание перечисленных организмов в 10 г сахара должно отсутствовать.
Используемые в пивоварении ферментные препараты могут быть источниками контаминации бактериями родов Bacillus, Pseudomonas, Micrococcus, уксуснокислыми, молочнокислыми бактериями и должны иметь микробную обсемененность не более 104 КОЕ/1 г (см3) ферментного препарата. Наиболее опасны для пивоварения молочнокислые, уксуснокислые бактерии и дикие дрожжи, а также строго анаэробные бактерии p. Pectinatus и p. Megasphaera.
Прессованные хмелевые шишки могут содержать споры мицелиальных грибов р. Neurospora, Alternaria, Pénicillium, Aspergillus. Разные виды хмеля (шишки, порошок, гранулы, экстракт) могут быть обсеменены бактериями p. Erwinia, Pseudomonus, Lactobacillus, Pediococcus, Klebsiella и спорами плесневых грибов.
Вода. При производстве пива используют воду, бактериологические требования к которой должны соответствовать требованиям СанПиН 2.1.4.1074-01 «Питьевая вода и водоснабжение населенных мест: Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
Точки микробиологического контроля воды на заводе:
- городская или колодезная вода;
- вода после водоподготовки;
- вода после дозировки диоксида хлора при дополнительной обработке;
- деаэрированная вода;
- технологическая вода и последние смывные воды;
- вода на ополаскивание в ринзере и бутылкомоечная машина (БММ);
- вода на впрыск.
Пробу воды для санитарно-микробиологического анализа отбирают в производственных помещениях и транспортируют согласно МУК 4.2.1018-01. Микробиологический контроль воды проводят не реже 1 раза в месяц. Чаще всего предприятия, разрабатывая свои схемы контроля, на отдельных этапах рекомендуют исследовать воду 1 раз в неделю или ежедневно. Вода на всех стадиях производства анализируется на разные показатели: общее микробное число, БГКП, дрожжи, плесневые грибы, молочнокислые бактерии. В воде допускается 0–50 клеток/см3 в зависимости от места отбора пробы, а в 100 см3 воды БГКП должны отсутствовать. Вода для пивоварения и промывная вода анализируются в количестве 100–500 см3 методом мембранной фильтрации.
Чистая культура и семенные дрожжи. Оценка качества дрожжей предполагает систематический микробиологический контроль за чистотой производственной культуры, условиями ее хранения, разведения и т. д. Состояние дрожжевой культуры не только определяет качество пива, но и обусловливает скорость главного брожения.
Очень часто семенные дрожжи контаминируют энтеробактерии, уксуснокислые (p. Gluconobacter и p. Acetobacter) и молочнокислые (p. Pediococcus и p. Lactobacillus) бактерии, дикие дрожжи, относящиеся к p. Saccharomycetes (S. cerevisiae var. diastaticus; S. cerevisiae var. ellipsoideus), а также Obesumbacterium proteus и бактерии p. Hafnia. Посторонние микроорганизмы в производственной культуре выявляют путем высева на различные питательные среды, дальнейшего микроскопирования и проведения дополнительных идентификационных тестов.
Микробиологический контроль производственной культуры кроме проверки биологической чистоты включает также определение ее физиологического состояния, биохимической активности, наличия производственно-ценных свойств, скорости размножения и т. п.
Определение количества мертвых клеток является неотъемлемой частью оценки состояния культуры дрожжей. Целесообразнее не использовать дрожжи с повышенным количеством мертвых клеток, чем вносить изменения в технологический процесс.
Семенные дрожжи, контаминированные дикими дрожжами, необходимо утилизировать, т. к. избавиться от них невозможно, а заражение при последующих циклах будет только усиливаться.
Все штаммы дрожжей, которые не используются в производстве пива, рассматриваются в качестве диких. Дикие дрожжи делятся на две группы: дрожжи, относящиеся к p. Saccharomyces (S. diastaticus, S. ellipsoideus), и дрожжи, не относящиеся к p. Saccharomyces (Candida tropicalis, Debaromyces, Pichia membranaefaciens, Hansenula anomala, Rhodotorula rubra, Torulopsis glabrata, Schizosacharomyces pombe и др.). Дрожжи верхового брожения также являются дикими, если в технологии используются дрожжи низового брожения.
Дифференцирование дрожжей среди других культур проводят путем посева образца на селективные питательные среды:
- рост на лизиновом агаре или агаре с сульфатом меди (2–5 сут, 24–25°С) позволяет выявить чужеродные дрожжи, не относящиеся к p. Saccharomyces;
- рост на кристалвиолетовом агаре или среде LWYM (2–5 сут, 24–25°С) позволяет выявить чужеродные дрожжи, относящиеся к
- рост на сусловом агаре (WA) 2 сут при 37°С позволяет выявить культурные дрожжи верхового брожения и дикие дрожжи, относящиеся и не относящиеся к р. Saccharomyces;
- рост в окончательно сброженном пиве (3–4 сут, 28°С) позволяет выявить «сверхсбраживаемые» дрожжи Saccharomyces diastaticus.
Выявление и идентификация диких дрожжей среди дрожжей низового брожения. Пробу дрожжей низового брожения (задаточные дрожжи, съемные дрожжи, дрожжи на дображивание) суспендируют в стерильной воде и делают посев на плотные (твердые) питательные среды для дифференцирования дрожжей:
- дрожжи, не относящиеся к Посев проводят на питательную среду с добавлением сульфата меди (агар Тейлора) или на лизиновый агар;
- дикие дрожжи, относящиеся к Анализируют рост на кристалвиолетовом агаре;
- дрожжи верхового брожения и другие дикие дрожжи выявляют посевом на сусловой агар
- дрожжи, обладающие высокой бродильной активностью, например Saccharomyces diastaticus, дают рост в окончательно сброженном пиве.
Выявление и идентификация диких дрожжей среди дрожжей верхового брожения. Пробу дрожжей верхового брожения (задаточные дрожжи, съемные дрожжи, дрожжи из танка дображивания) высевают на плотные (твердые) питательные среды для дифференцирования дрожжей:
- дрожжи, не относящиеся к выявляют посевом на УМ агар с добавлением сульфата меди (агар Тейлора) или на лизиновый агар;
- рост на кристалвиолетовом агаре дают дикие дрожжи, относящиеся к
- дрожжи низового брожения и другие дикие дрожжи выявляют посевом на пантотеновый агар (2-4 сут культивирования при 28°С) или на мелибиозовый агар (культивирование 2 сут при 28°С);
- дрожжи, обладающие высокой бродильной активностью, например, Saccharomyces diastaticus, дают рост в окончательно сброженном пиве.
Обнаружение бактерий в культурных дрожжах. Микробиологический контроль с целью обнаружения бактерий-контаминантов проводят путем высева проб культурных дрожжей на следующие питательные среды:
- VLB-S7-S-быльон, VLB-S7-S-arap, NBB-агар, UBA сдобавкойАВР. При культивировании 5–7 суток при 27-30°С в анаэробных условиях обнаруживаются представители родов Lactobacillus, Pediococcus, Micrococcus, Streptococcus, Lactococcus, Leuconostoc, Megasphaera, Pectinatus, Zymomonas. При росте в бульоне происходит помутнение и подкисление среды, выпадает осадок и нарушаются органолептические характеристики;
- актидионовый агар (стандарт-1-агар, WLN-arap или UBA с добавлением актидиона (100 мг/см3)) используют для выделения бактерий, а также идентификации Obesumbacterium proteus, Enterobacter и актидионустойчивых дрожжей. Культивирование проводят 3 суток при 27–30°С в аэробных условиях.
В настоящее время количество мертвых клеток при съеме дрожжей не должно превышать 3–5 %. В случае получения повышенных значений – более 5 % – требуется немедленное вмешательство в производство, т. к. высокий процент мертвых клеток указывает на необходимость корректировки ряда этапов технологии.
В семенных дрожжах микроскопированием определяют «упитанность» или количество клеток с гликогеном. Более 75 % дрожжей должны содержать гликоген.
Пробирки с чистой культурой дрожжей до начала работы хранят на скошенном агаре закрытыми в холодильнике при температуре 4–5 ºС не более 3 мес. При разведении культуры клетки дрожжей бактериологической петлей переносят со скошенного сусло-агара в пробирки с суслом и инкубируют 24 ч при температуре 25ºС. Затем каждые 24 ч дрожжи переносят в сусло большего объема и инкубируют при комнатной температуре. На каждой стадии производится микробиологический контроль, который включает определение аэробных микроорганизмов, молочнокислых бактерий и диких дрожжей, а также подсчет концентрации дрожжевых клеток и процент мертвых и почкующихся клеток. На последней стадии дрожжи помещаются в колбу Карлсберга, заполненную стерильным суслом. Концентрация дрожжевых клеток должна быть не менее 60–80 млн/см3.
Сусло. Качественное определение микробиологической контаминации сусла определяют путем длительного культивирования (24–72 ч) 180 см3 отстаиваемой пробы сусла при 25–28°С. Ежесуточно ведут контроль, фиксируя помутнение (образование диметилсульфида) в течение 72 ч.
Количественное определение бактерий проводят путем высева 10 см3 сусла, разведенного в 100 см3 физиологического раствора методом мембранной фильтрации, используя среду UBA для выделения аэробов и анаэробов. Через 72 ч инкубации при 25–28ºС определяют число колоний аэробных микроорганизмов.
Энтеробактерии определяют на средах MacConkey-arap или Эндо. В охлажденном сусле и в сусле после аэрации определяют общее число микроорганизмов и молочнокислые бактерии (МКБ). Сусло отбирается стерильно из крана после теплообменников еженедельно и анализируется методом мембранной фильтрации на присутствие дрожжей, плесневых грибов и молочнокислых бактерий посевом на селективные среды (сусловой агар, MRS, VLB-S7-S-arap).
Микробиологический контроль сусловарочного цеха приведен в табл. 6.
Таблица 6
Микробиологический контроль сусловарочного цеха
| Проба | Количество (время, объем) | Место отбора | Периодичность анализа | ||||
| Отстаивание | ОМЧ | МКБ | Дрожжи | Энтеробактерии | |||
| Сусло | 10 см3 | На выходе из охладителя | Не менее 1 раза в неделю | – | – | ||
| Воздух | 30 мин | Аэрация сусла | Ежемесячно | – | |||
| Сусло для разведения культуры дрожжей | 10 см3 | Из стерилизатора после охлаждения | Еженедельно | ||||
| Дезинфи цирующие средства | 100 см3 | СИП-установка | – | Ежемесячно | |||
| Промывная вода | 100 см3 | Сусловарочные аппараты, теплообменники | – | После мойки | |||
Сусло, используемое в лаборатории, исследуется каждый раз при разведении чистой культуры дрожжей. В 10 см3 сусла микроорганизмы не допускаются. На многих предприятиях введены более жесткие нормативы – тогда количество микроорганизмов не допускается в 20 или 50 см3. Обнаружение любых диких, культурных дрожжей или бактерий свидетельствует о плохом санитарно-гигиеническом состоянии и потенциальных микробиологических проблемах.
Готовое пиво. Качество готового пива в настоящее время регламентируется действующими СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
Качество и безопасность пива оцениваются по двум группам показателей: химическим и микробиологическим.
Химические показатели (допустимые уровни, мг/кг, не более):
| Свинец | 0,3 |
| Мышьяк | 0,2 |
| Кадмий | 0,03 |
| Ртуть | 0,005 |
| Нитрозамины | 0,003 |
|
Радионуклиды (Бк/л): цезий-137 стронций-90 |
70 100 |
В зависимости от вида пива и сроков его хранения в продукте допускаются разные показатели микробиологической контаминации:
- пиво разливное, непастеризованное: БГКП в 1 см3 – не допускаются; патогенные микроорганизмы, в том числе Salmonella в 25 см3, – не допускаются;
- пиво непастеризованное нефильтрованное и фильтрованное необеспложенное: БГКП в 3 см3 (в кегах) и в 10 см3 (в бутылках) – не допускаются; патогенные микроорганизмы, в том числе Salmonella в 25 см3 – не допускаются;
- пиво пастеризованное и обеспложенное: КМАФАнМ – не более 500 КОЕ/100 см3; БГКП в 10 см3 – не допускаются; патогенные микроорганизмы, в том числе Salmonella в 25 см3, – не допускаются; дрожжи и мицелиальные грибы в 40 см3 – не допускаются.
В готовом пиве токсичные элементы оценивают 2 раза в год и 1 раз в год – радионуклиды.
Микробиологический контроль на отдельных этапах производства представлен в табл. 7.
Тара. Бутылки, алюминиевые банки. Бутылки (стекло или ПЭТ) и банки отбираются в количестве 3 штук после бутылкомоечной машины (или ополаскивателя). Каждую ополаскивают 100 см3 стерильного физиологического раствора, который затем анализируется методом мембранной фильтрации.
Анализ кегов. Еженедельно (в случае необходимости ежедневно при каждом наливе) с 2 кегов (наружный и внутренний круг филлера) анализируют микробиологическую чистоту. Для этого обжигают головку кега газовой горелкой и наливают в кег 200 см3 стерильного физраствора или воды. 100 см3 смывной воды затем анализируется методом мембранной фильтрации.
Таблица 7
Микробиологический контроль отдельных этапов производства
| Проба | Количество (время, объем) | Место отбора | Периодичность анализа | |||
| ОМЧ | МКБ | Дрожжи | Энтеробактерии | |||
| Вносимые дрожжи | 100/см3 | Пропагация | Перед внесением в танк | – | ||
| Снятые дрожжи | 100/см3 | Дрожжевой танк | После каждого снятия | – | ||
| Молодое пиво | 100/см3 | Бродильный танк | – | Все танки | – | |
| Смыв с оборудования | 100 см3 | Бродильный танк ЦКТ, оборудование цеха | После каждой СИП мойки | – | ||
| Воздух | 10 мин | Цех | – | Ежемесячно | – | |
| Вода | 100 см3 | Цех | – | Ежемесячно | ||
| Смыв | 100 см3 | Насос для перекачки дрожжей, чистые танки брожения | – | После СИП | ||
| Последние промывные воды | 100 см3 | Система трубопроводов | – | После СИП | ||
| Дезинфицирующие средства | 100 см3 | СИП-установка | – | Ежемесячно | ||
| Последние промывные воды | 100 см3 | Оборудование для перекачки на дображивание; танки дображивания | – | После СИП | ||
| Смыв | Мазок | Уплотнение крышки танка, сливное отверстие танка, система трубопроводов | – | После СИП | ||
| СО2 | 30 мин/800 см3 | После фильтра | Ежемесячно, в случае необходимости чаще | – | ||
| Пиво в лагерном танке | 100 см3 | Выход лагерного танка, насос для забора проб; смеситель пива | Ежемесячно | Нет | ||
| Кизельгур | Новая партия; емкость дозирования | – | Ежемесячно | – | ||
| Пиво | 100 см3 | После кизельгура | – | Ежедневно | Ежедневно | Ежедневно |
| СО2 | 1 мин | Карбонизация | – | 1 раз в сутки | 1 раз в месяц | – |
| Пиво | 100 см3 | Танк | – | Все танки | ||
| Последние промывные воды | 100 см3 | Танки высокого давления; трубопроводы | – | После СИП | ||
| СО2 | 1 мин | Создание противодавлений – форфасы, баллоны, резервуары | – | Ежемесячно, в случае необходимости чаще | ||
Во всех смывах определяют общее микробное число и оценивают наличие диких дрожжей, молочнокислых бактерий. Вымытые бутылки не должны содержать молочнокислых бактерий и педиококков, дрожжей p. Saccharomyces и плесневых грибков.
Укупорочный материал. Кронен-пробки (10 штук) для микробиологического анализа отбирают из бункера перед укупором или с транспортера стерильным пинцетом в стерильную емкость с крышкой. Анализ микробиологической чистоты проводят не менее 2 раз в месяц, чаще – еженедельно.
В лаборатории пробки ополаскиваются стерильным 0,9%-ным раствором хлорида натрия, который затем анализируется методом мембранной фильтрации. БГКП и другие микроорганизмы в 1 см3 исследуемого раствора не допускаются.
Крышки для банок анализируют в количестве 5–10. С крышек берут смывы стерильным тампоном (так же можно делать смывы и с кронен-пробок). Общую обсемененность анализируют методом мембранной фильтрации.
Оборудование, коммуникации. Ровные гладкие поверхности могут быть исследованы методом смыва с поверхности, а также путем соприкосновения с питательной средой оттиска (препарат-отпечаток), который затем культивируется. При использовании метода «смыв с поверхности» лучше подходят стерильные ватные тампоны. После отбора пробы тампон вносится в бутылку со стерильной водой либо с физиологическим раствором или обламывается. Качество мойки оборудования, трубопроводов оценивают, анализируя последнюю промывную воду, которую подвергают мембранной фильтрации с последующим высевом на питательные среды.
Воздух производственных помещений и воздух, подаваемый на аэрацию дрожжей. Для определения количества микроорганизмов в воздухе производственных помещений используют седиментационный и аспирационный методы, описанные ранее (см. предыдущую главу). Анализ проводят не менее 1 раза в месяц. Определяют общее число микроорганизмов в 1 м3 воздуха. В воздухе варочного цеха, солодовни, дрожжевого отделения пивоваренного предприятия должно быть не более 50 микроорганизмов на 100 см3.
В настоящее время на пивоваренных предприятиях состояние воздуха для аэрации оценивают путем его пропускания в течение 30 мин через колбу со стерильной водой или солодовым суслом, содержащим 8-10% сухих веществ (СВ), с последующим посевом на плотную питательную среду.
Воздух, подаваемый на аэрацию сусла, исследуется еженедельно, воздух для аэрации чистой культуры дрожжей следует оценивать при каждом разведении. Кроме того, рекомендуется два раза в месяц исследовать воздух, направляемый на выдув ПЭТ бутылок. В воздухе отделения чистых культур, варочного цеха определяют ОМЧ, молочнокислые бактерии, дикие дрожжи, плесневые грибы. Воздух, используемый на аэрацию, не должен содержать клеток в 1 см3, присутствие молочнокислых бактерий, плесневых грибов, посторонних дрожжей не допускается.
Возможные точки отбора проб воздуха и СО2 представлены в табл. 8.
Таблица 8
Микробиологический контроль воздуха и СО2
| Проба | Количество (время, объем) | Место обора | Периодичность анализа | ||
| ОМЧ | МКБ | Дрожжи | |||
| Воздух помещения | 10 мин | Дрожжевой цех; бродильный цех; цех розлива | Ежемесячно | – | |
| Сжатый воздух |
30 мин/ 800 см3 |
Аэрация сусла | Еженедельно | ||
| СО2 | 30 мин/ 800 см3 | Фильтрационный цех (карбонизация) | – | Еженедельно | |
| Лагерное, форфасное отделения. Карбонизация (танки, бутылки) | – | Ежемесячно | |||
Примечание. Воздух помещения на энтеробактерии не анализируют.
Каждое пивоваренное предприятие разрабатывает свои внутризаводские схемы микробиологического контроля производства, учитывая производительность завода, сезонность, частоту встречаемости посторонней микрофлоры, используемую тару и т. д.
В настоящее время микробиологический контроль охватывает все этапы технологического процесса и к микробиологическим показателям предъявляются более жесткие требования, чем несколько лет назад. В табл. 9, 10 и 11 представлены примеры некоторых схем микробиологического контроля, включая мини-заводы, которые применялись ранее. Современная схема микробиологического контроля представлена в прил. 2.
Таблица 9
Схема микробиологического контроля, используемая ранее (завод 1)
| Объект контроля | Точка отбора проб | Периодичность контроля | Метод анализа | Показатель |
| Вода | Основные линии подачи воды в производственные помещения |
1 раз в месяц
|
Глубинный посев | ОМЧ |
| Мембранная фильтрация | БГКП | |||
| Сусло | После теплообменника | 4 раза в месяц | Глубинный посев | ОМЧ, кислотообразующие бактерии |
| Дрожжи (чистая культура) | Из танков брожения | При передаче | Микроскопирование в капле щелочи | Бактерии, нежизнеспособные дрожжи |
|
Семенные дрожжи
|
Дрожжевые ванны
|
Ежедневно в процессе хранения | Бактерии, нежизнеспособные дрожжи, содержание гликогена | |
| При подозрении на дикие дрожжи | Поверхностый посев на селективные среды | Дикие дрожжи | ||
|
Пиво готовое
|
С линии розлива
|
2 раза в месяц (по каждому сорту) | Глубинный посев | ОМЧ |
| Бродильный посев, мембранная фильтраций | БГКП | |||
| Бутылки | С транспортера после ополаскивания | 1 раз в неделю | Глубинный посев | ОМЧ, БГКП |
| Укупорочный материал | С рабочего места | ОМЧ | ||
| Воздух на технологические нужды | После воздушных фильтров | 1 раз в месяц | Седиментационный метод | ОМЧ |
| Углекислота | После фильтров | 1 раз в месяц | Экспозиция 1 мин | ОМЧ |
|
Эффективность санобработки технологического оборудования (смывная вода)
|
Технологическое оборудование, коммуникации
|
После каждой мойки и дезинфекции | Глубинный посев | ОМЧ |
| Бродильная/мембран-ная фильтрация | БГКП |
Таблица 10
Схема микробиологического контроля (завод 2)
| Объект контроля | Точка отбора проб |
Периодичность контроля | Метод анализа | Показатель |
| Вода | Основные линии подачи воды в производственные помещения и моечную машину | 1 раз в месяц | По ГОСТ 18963-73 | ОМЧ, БГКП |
| Сусло | После теплообменника | 4 раза в месяц |
Глубинный посев
|
ОМЧ, кислотообразующие бактерии |
| Из стерилизатора после охлаждения (при разведении ЧК дрожжей) | Каждый раз | ОМЧ | ||
|
Дрожжи ЧК (чистая культура)
|
Из цилиндров брожения | При передаче | Микроскопирование в 10%-ной щелочи | Бактерии |
|
Емкость предварительного брожения (при ручном разведении)
|
Нежизнеспособные дрожжи, дикие дрожжи | |||
| При подозрении на дикие дрожжи | Поверхностый посев | Дикие дрожжи | ||
|
Семенные дрожжи
|
Дрожжевые ванны, монжю
|
Ежедневно в процессе хранения | Микроскопи-рование в капле щелочи | Бактерии, нежизнеспособные дрожжи, содержание гликогена |
| При подозрении на дикие дрожжи | Поверхностный посев на селективные среды | Дикие дрожжи | ||
| Пиво готовое | С линии розлива |
2 раза в месяц (по каждому сорту)
|
Глубинный посев | ОМЧ |
| Бродильный или по ГОСТ 18963-73 | БГКП | |||
| От каждой партии 2 бутылки | Термостатирование | Стойкость | ||
| Бутылки | С транспортера после мойки (5 бутылок) | 1 раз в цикл работы | Глубинный посев | ОМЧ |
| Укупорочный материал | С рабочего места | 1 раз в неделю | ОМЧ | |
| Воздух на технологические нужды | После воздушных фильтров | 1 раз месяц | Экспозиция 1 мин | ОМЧ |
|
Воздух отделения ЧК дрожжей
|
Воздух помещения | В период разведения ЧК | Экспозиция 5, 10, 15 мин | ОМЧ |
| Для аэрации ЧК дрожжей | Экспозиция 1 мин | ОМЧ, молочнокислые бактерии, плесневые грибы, дикие дрожжи | ||
| Эффективность санобработки технологическо-го оборудования (смывная вода) | Технологическое оборудование, коммуникации | После каждой санобработки | Глубинный посев, микроскопирование | ОМЧ |
| Бродильный метод | БГКП |
Таблица 11
Схема микробиологического контроля № 3 (мини-завод)
| Объект исследования | Периодичность | Метод анализа | Показатель |
|
Готовая продукция
|
2 пробы в месяц
|
Глубинный посев | ОМЧ |
| Бродильный, мембранный фильтр | БГКП | ||
| Вода холодная | 1 раз в квартал | Глубинный посев | ОМЧ |
| Смывы с оборудования* | 2, 5, 8, 11-й месяц; 1 раз в месяц (10 проб) | Бродильный, мембранный фильтр |
БГКП БГКП |
Примечание. Анализируемые объекты: варочный аппарат, внешняя и внутренняя поверхность ЦКТ, внутренняя поверхность шланга, пробоотборочный кран, переходник, теплообменник, воздушный фильтр, танк для горячей воды.