ГОСТ 21237-75
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЯСО
МЕТОДЫ БАКТЕРИОЛОГИЧЕСКОГО АНАЛИЗА
Москва
Стандартинформ
Издание официальное
Группа Н19
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЯСО
Методы бактериологического анализа
ГОСТ
21237-75
Meat
Methods of bacteriological analysis
МКС 07.100.30
67.120.10
ОКСТУ 9209
Дата введения 01.01.77
Настоящий стандарт распространяется на мясо и субпродукты от всех видов убойного скота и устанавливает методы бактериологического исследования для выявления в них аэробных бактерий (бацилл сибирской язвы, бактерий из рода сальмонелл, бактерий из рода кишечной палочки – Эшерихий, бактерий из рода протея, бактерий рожи свиней, бактерий листериоза, бактерий пастереллеза, бактерий из группы кокков) и анаэробных бактерий (патогенных и токсигенных клостридий).
Бактериологическое исследование мяса и субпродуктов производят во всех случаях, предусмотренных действующей нормативно-технической документацией, правилами ветеринарно-санитарной экспертизы мяса и мясопродуктов и другими нормативными актами, а также по требованию органов, осуществляющих ветеринарный или санитарный надзор.
(Измененная редакция. Изм. № 2).
1. МЕТОДЫ ОТБОРА ОБРАЗЦОВ
1.1. В зависимости от характера заболевания на бактериологическое исследование направляют от туши:
- часть мышцы сгибателя или разгибателя передней и задней конечностей туши длиной не менее 8 см или кусок другой мышцы размером не менее 8-6-6 см;
- лимфатические узлы – поверхностный шейный или собственно подкрыльцовый и наружный подвздошный вместе с окружающей их соединительной и жировой тканью, а от свиней – поверхностный шейный дорзальный (при отсутствии патологических изменений в области головы и шеи) или подкрыльцовый первого ребра и надколенный;
- долю печени с печеночным лимфатическим узлом или желчным пузырем, освобожденным от желчи, почку и селезенку.
Для бактериологического исследования на листериоз направляют: головной мозг, долю печени и почку.
Для бактериологического исследования на возбудителя сибирской язвы направляют лимфатический узел пораженного органа или лимфатический узел, собирающий лимфу с места локализации подозрительного фокуса, отечную ткань, ухо, а у свиней, кроме того, подчелюстной лимфатический узел.
При исследовании полутуш или четвертин туш берут кусок мышцы, лимфатические узлы и трубчатую кость.
При исследовании соленого мяса, находящегося в бочечной таре, берут образцы мяса и имеющиеся лимфатические узлы сверху, из середины и со дна бочки, а также, при наличии, трубчатую кость и рассол.
Примечание. Если берут часть печени, почки, селезенки, то поверхность разреза прижигают.
1.2. Образцы завертывают каждый в отдельности в полиэтиленовую пленку по ГОСТ 10354 или пергамент по ГОСТ 1341, помещают в бумажный пакет, на котором ставят дату отбора образца, номер туши и направляют в лабораторию в общей таре (ящике).
1.3. При необходимости пересылки образцов в лабораторию, расположенную за пределами предприятия или хозяйства, где отбирают образцы, тару с образцами опечатывают или пломбируют. В сопроводительном документе указывают:
- наименование продукта с указанием вида мяса, от которого взят образец, и его количество;
- наименование предприятия или хозяйства, где отобран образец, и его адрес;
- номера образцов;
- причину направления образцов на исследование;
- краткие патологоанатомические данные и предполагаемый диагноз;
- дату взятия образцов и подпись лица, направившего их на исследование.
2. АППАРАТУРА, МАТЕРИАЛЫ, РЕАКТИВЫ И ПИТАТЕЛЬНЫЕ СРЕДЫ
2.1. Для проведения бактериологического исследования применяют:
автоклав;
аппарат Коха;
баню водяную с терморегулятором;
весы лабораторные общего назначения по ГОСТ 24104;
весы торзионные;
гомогенизатор бактериологический или аппарат для измельчения тканей с числом оборотов не менее 8000 об/мин и не более 45000 об/мин;
горелки газовые;
дистиллятор;
котлы с паровой рубашкой;
компаратор;
лупу с увеличением 3-5 по ГОСТ 25706;
микроскоп типа МБИ или МБР или других аналогичных марок;
мясорубку бытовую по ГОСТ 4025;
ножи;
ножницы медицинские по ГОСТ 21239;
осветитель ОИ-19;
пинцеты медицинские по ГОСТ 21241;
потенциометр или рН-метр;
спиртовки стеклянные лабораторные по ГОСТ 25336;
термостат электрический с автоматическим регулятором;
ультратермостат;
флаконы Сокслета (бутылки для детского питания);
холодильник электрический бытовой по ГОСТ 16317;
часы песочные по ОСТ 25-11-38 на 1, 2, 5 и 15 мин;
шкаф сушильный электрический лабораторный;
бумагу фильтровальную по ГОСТ 12026;
бутылки стеклянные;
вату медицинскую гигроскопическую по ГОСТ 5556;
воду бромную;
воду дистиллированную по ГОСТ 6709;
воду питьевую по ГОСТ 2874*;
_____
* На территории Российской Федерации действует ГОСТ Р 51232-98
воронки стеклянные по ГОСТ 25336, конусообразные, вместимостью 250, 500 см3;
дрожжи прессованные по ГОСТ 171;
желчь крупного рогатого скота свежую или сухую обезвоженную;
кастрюли;
колбы стеклянные лабораторные по ГОСТ 25336;
кровь крупного рогатого скота, овец, лошадей;
марлю медицинскую по ГОСТ 9412;
масло вазелиновое медицинское по ГОСТ 3164;
масло иммерсионное для микроскопии по ГОСТ 13739;
мел химически осажденный по ГОСТ 6253;
мясо – говядину по ГОСТ 779;
панкреатин пищевой сухой;
пенициллин;
пептон венгерской фирмы «Рихтер»;
пептон сухой ферментативный для бактериологических целей по ГОСТ 13805;
пептон чешской фирмы «Спофа»;
петледержатели;
печень говяжью;
пипетки вместимостью 1, 2 см3 с ценой деления 0,05 и 0,1 см3 и вместимостью 10 см3;
плазму цитратную кроличью сухую;
железу поджелудочную крупного рогатого скота;
поплавки для пробирок и колб длиной 20, 45 и 75 мм, диаметром соответственно 2, 5 и 10 мм;
посуду мерную стеклянную по ГОСТ 1770;
набор агглютинирующих адсорбированных сальмонеллезных сывороток: поливалентной О-сыворотки групп А, В, С, D и Е и моновалентных О- и Н-сывороток;
пробирки стеклянные бактериологические по ГОСТ 25336;
пробки корковые по ГОСТ 5541;
пробки резиновые;
проволоку из никелевых сплавов диаметром 0,3-0,5 мм по ГОСТ 1791;
спирт этиловый ректификованный по ГОСТ 5962* или спирт этиловый ректификованный технический по ГОСТ 18300;
_____
* На территории Российской Федерации действует ГОСТ Р 51652-2000
спирт денатурированный;
стекла покровные по ГОСТ 6672;
стекла предметные по ГОСТ 9284;
ступки фарфоровые с пестиками по ГОСТ 9147;
хлороформ технический по ГОСТ 20015;
цилиндры вместимостью 100, 250, 500 см3 по ГОСТ 1770;
чашки с крышками стеклянные лабораторные по ГОСТ 25336 (чашки Петри);
штативы для пробирок;
шумовку;
эозин бактериологический;
яйца куриные;
бриллиантовый зеленый:
бромтимоловый синий;
генциан фиолетовый (генцианвиолет);
глицерин по ГОСТ 6259, х.ч.;
Д-глюкозу по ГОСТ 6038, Д (+), х.ч.;
желатин по ГОСТ 11293;
йод металлический по ГОСТ 4159, х.ч.;
калий йодистый по ГОСТ 4232, х.ч.;
калий фосфорнокислый двузамещенный по ГОСТ 2493, х.ч.;
калий фосфорнокислый однозамещенный по ГОСТ 4198, х.ч.;
кислоту карболовую кристаллическую;
кислоту фосфорную по ГОСТ 6552;
кристаллический фиолетовый (кристаллвиолет);
лактозу, х.ч.;
магний сернокислый по ГОСТ 4523, х.ч.;
магний хлористый по ГОСТ 4209, х.ч.;
маннит (маннитол) по ТУ 6-09-5484, х.ч., Д (-);
синь метиленовую;
метиловый красный по ТУ 6-09-5169;
метиловый фиолетовый медицинский (метилвиолет);
мочевину по ГОСТ 6691, х.ч.;
набор углеводов для исследования ферментации микробов кишечной группы (большой);
натрий-аммоний фосфорнокислый по ГОСТ 4170;
натрия гидроокись по ГОСТ 4328;
натрий двууглекислый по ГОСТ 4201, х.ч.;
натрий кислый селенистокислый (без теллура);
натрий лимоннокислый по ГОСТ 22280;
натрий сернистокислый (сульфит натрия) безводный по ГОСТ 195, х.ч.;
тиосульфат натрия по ГОСТ 27068, х.ч.;
натрий фосфорнокислый двузамещенный безводный по ГОСТ 11773, х.ч.;
натрий фосфорнокислый однозамещенный по ГОСТ 245, х.ч.;
натрий хлористый по ГОСТ 4233, х.ч.;
парадиметиламидобензальдегид;
сафранин;
сахарозу по ГОСТ 5833, х.ч.;
свинец уксуснокислый по ГОСТ 1027;
соль закиси железа и аммония двойную сернокислую (соль Мора) по ГОСТ 4208;
фенол;
феноловый красный по ТУ 6-09-5170, х.ч.;
фуксин кислый для микробиологических целей;
фуксин основной для микробиологических целей;
агар микробиологический по ГОСТ 17206;
агар сухой питательный;
агар Плоскирева сухой бактериологический;
arap сухой висмут-сульфит;
агар сухой с эозин-метиленовым синим (среда Левина);
воду мясную по ГОСТ 20729;
бульон мясо-пептонный по ГОСТ 20730;
диализат или экстракт дрожжевой;
раствор Хенкса;
сальмонеллезный О-бактериофаг.
сибиреязвенный фаг «гамма МВА».
(Измененная редакция. Изм. № 1,2).
3. ПОДГОТОВКА К ИССЛЕДОВАНИЮ
3.1. Приготовление питательных сред, реактивов, красок
3.1.1. Приготовление мясо-пептонного агара
К 1000 см3 мясо-пептонного бульона перед стерилизацией добавляют 20 г агара и кипятят на слабом огне при постоянном помешивании до полного растворения.
Мясо-пептонный агар, охлажденный до температуры 50-55 ºС, осветляют яичным белком (из расчета один белок на 1000 см3 мясо-пептонного агара), помешают в автоклав, не завинчивая крышку автоклава, или в аппарат Коха на 1 ч, чтобы белок свернулся и, оседая, увлек за собой взвешенные частицы. Горячий мясо-пептонный агар фильтруют через ватно-марлевый фильтр, устанавливают в нем рН 7,0-7,4, разливают во флаконы или пробирки и 20 мин стерилизуют в автоклаве при температуре 120 ºС.
3.1.2. Приготовление основного раствора Хоттингера
1000 г мяса, освобожденного от жира и сухожилий, нарезают кусками размером 1-2 см и опускают небольшими порциями в кастрюлю с двойным количеством кипящей водопроводной воды. Кипятят в течение 15-20 мин, пока цвет мяса не станет серым; это указывает на то, что белки свернулись. Мясо вынимают шумовкой и измельчают на мясорубке. Оставшуюся жидкость фильтруют и в ней устанавливают рН 8,0. Фарш опускают в отфильтрованную жидкость и охлаждают до температуры 40 ºС в открытой кастрюле, затем добавляют очищенную от жира, соединительной ткани и дважды измельченную поджелудочную железу в количестве 10 % к полученной взвеси (на 1000 см3 жидкости 100 г железы) или сухой панкреатин в количестве 0,5-1,0 % (в зависимости от его активности). Полученную смесь хорошо размешивают, после чего снова подщелачивают 10%-ным раствором гидроокиси натрия до рН 7,8-8,0 и повторяют такое же подщелачивание через 30 мин. Отсутствие сдвига реакции смеси указывают на его доброкачественность.
После установления рН смесь переливают в бутыль с хорошо подобранной резиновой пробкой с таким расчетом, чтобы 1/3 часть бутылки оставалась свободной. Затем добавляют в количестве 1-3% от объема хлороформа (в холодное время года – меньше, чем в теплое), закрывают бутыль пробкой и несколько раз встряхивают, после чего вынимают пробку для удаления избытка хлороформа и тут же снова закрывают.
Через 1-2 ч после добавления поджелудочной железы или панкреатина проверяют реакцию, устанавливают рН 7,4-7,6 и оставляют смесь для переваривания на 7-16 суток при комнатной температуре до образования аморфного осадка.
Первые 3-4 суток переваривания ежедневно проверяют реакцию среды и поддерживают рН на уровне 7,4-7,6. В течение этого времени встряхивают жидкость не менее трех раз в сутки так же, как указано выше. В дальнейшем встряхивать можно реже.
За 1-2 суток до окончания переваривания встряхивание прекращают, чтобы гидролизат отстоялся. Конец переваривания характеризуется следующими признаками: на дне бутылки собирается атмосферный осадок; жидкость над осадком просветляется и принимает соломенно-желтый цвет; гидролизат легко фильтруется; реакция на триптофан с бромной водой должна быть положительной (в пробирку наливают 3-4 см3 фильтрованного гидролизата, добавляют три-четыре капли бромной воды); при наличии триптофана жидкость принимает розово-фиолетовый цвет, в то время как контрольная пробирка с гидролизатом без бромной воды имеет желтое окрашивание. 5%-ный гидролизат должен содержать 1,1-1,2% общего азота. После гидролиза жидкость фильтруют через полотняный или бумажный фильтр, сливают в бутыль и стерилизуют в течение 30 мин при температуре 120 ºС.
Приготовленную среду можно хранить пять месяцев. Перед употреблением жидкость фильтруют.
(Измененная редакция. Изм. № 2).
3.1.3. Приготовление бульона Хоттингера
К 100 см3 основного раствора добавляют 500 см3 водопроводной воды, 3 г хлористого натрия и 0,12 г двузамещенного фосфорнокислого калия. Полученный раствор кипятят в течение 10 мин, фильтруют, устанавливают рН 7,2-7,4 и стерилизуют в течение 20 мин при температуре 120ºС.
3.1.4. Приготовление физиологического раствора
В 1000 см3 дистиллированной воды растворяют 8,5 г химически чистого хлористого натрия. Раствор доводят до кипения, охлаждают, фильтруют через бумажный фильтр, разливают в колбы или пробирки и стерилизуют 20 мин в автоклаве при температуре 120 ºС.
3.1.5. Приготовление среды Левина
К 100 см3 расплавленного мясо-пептонного агара с рН 7,0-7,4. приготовленного по п. 3.1.1, добавляют 2 см3 0,5%-ного водного раствора предварительно подогретой на водяной бане метиленовой сини, 1,5 см3 2 %-ного раствора эозина (бактериологического), 2 г лактозы и 0,2 г двузамещенного фосфорнокислою калия. Растворы красок готовят на дистиллированной воде и стерилизуют 1 ч при температуре 100 °С. После добавления всех компонентов в указанном порядке среду тщательно перемешивают, разливают в чашки и подсушивают. Среда должна иметь красно-фиолетовый цвет.
Среда Левина может быть приготовлена из сухой стандартной среды по прописи, указанной на этикетке.
3.1.6. Среды фуксин-сульфитный агар (среда Эндр), бактоагар Плоскирева, висмут-сульфит агар (среда Вильсон-Блера) могут быть приготовлены из сухих стандартных сред по прописи, указанной на этикетке.
3.1.7. Приготовление среды Мюллера
Для приготовления среды Мюллера вначале готовят растворы серноватистокислого натрия и Люголя.
В мерный цилиндр с 50 г серноватистокислого натрия добавляют до 100 см3 дистиллированной воды. Раствор переливают в бутыль и стерилизуют текучим паром в течение 30 мин.
Для приготовления раствора Люголя в 100 см3 дистиллированной воды растворяют 25 г металлического йода, 20 г йодистого калия.
Для приготовления среды Мюллера в стерильные флаконы помещают по 4,5 г мела и стерилизуют их сухим паром в течение 1 ч. Затем наливают в каждый флакон по 90 см3 бульона из перевара Хоттингера, содержащего 0,13-0,15% аминного азота, устанавливают рН 7,2-7,4 и стерилизуют при температуре 120°С. После стерилизации вновь устанавливают рН 7,2-7,4, для чего проверяют в одном из флаконов и определяют необходимый для подтитровки данного количества среды объем соляной кислоты или гидроокиси натрия. Затем в асептических условиях перед употреблением добавляют по 2 см3 раствора Люголя и по 10см3 раствора серноватистокислого натрия.
(Измененная редакция, Изм. № 2).
3.1.8. Приготовление среды Кауфмана
К 500 см3 стерильной среды Мюллера, приготовленной по п. 3.1.7, добавляют 25 см3 стерильной желчи крупного рогатого скота и 5 см3 0,1%-ного водного раствора бриллиантовой зелени. Смесь хорошо взбалтывают, разливают в стерильные флаконы, но не стерилизуют.
3.1.9. Приготовление селенитового Ф-бульона
Среду готовят из двух основных растворов – А и Б.
Раствор А состоит из 5 г пептона чешской фирмы «Спофа» или венгерской фирмы «Рихтер», 7 г безводного двузамещенного фосфорнокислого натрия, 3 г однозамещенного фосфорнокислого натрия, 4 г х.ч. лактозы, 100 см3 дистиллированной воды, рН раствора 6,9-7,1. Раствор стерилизуют 30 мин при температуре 112 ºС.
Раствор Б состоит из 10%-ного раствора кислого селенистокислого натрия, приготовленного на стерильной воде. Раствор готовят непосредственно перед употреблением.
При изменении серии любого из входящих в среду компонентов (пептона, кислого селенистокислого натрия, фосфатов) проводят предварительно подтитровку, для чего экспериментально определяют точную пропорцию фосфорнокислого двузамещенного безводного натрия и фосфорнокислого однозамещенного натрия, которая с используемыми образцами пептона и селенистокислого натрия дает рН не выше 6,9-7,1, что регулируется изменением соотношения фосфатов.
Для приготовления селенитовой среды к 50 см3 раствора А стерильно добавляют 2 см3 раствора Б. Среду разливают в стерильные флаконы ил и колбы, но не стерилизуют.
3.1.10. Приготовление хлористомагниевой среды «М» (модифицированной)
Среду готовят из трех основных растворов А, Б и В.
Для приготовления раствора А в 90 см3 дистиллированной воды растворяют 0,42 г сухого ферментативного пептона, 0,7 г хлористого натрия, 0,15 г однозамещенного фосфорнокислого калия, 4 см3 дрожжевого диализата.
Для приготовления раствора Б в 9 см3 дистиллированной воды растворяют 3,6 г кристаллического хлористого магния.
Раствор В состоит из 0,09 см3 5%-ного водного раствора бриллиантовой зелени.
Для приготовления хлористомагниевой среды «М» (модифицированной) растворы А, Б и В смешивают и стерилизуют 30 мин при температуре 112,5 ºС.
Концентрированную среду готовят, удваивая содержание всех компонентов, кроме дистиллированной воды.
При отсутствии дрожжевого диализата допускается применять дрожжевой экстракт.
3.1.11. Приготовление дрожжевого экстракта
В 2000 см3 дистиллированной воды растворяют 1000 г прессованных хлебопекарных дрожжей. Полученную суспензию стерилизуют 30 мин текучим паром, затем отстаивают в холодильнике при температуре 4ºС в течение 5-6 суток.
Жидкость над осадком декантируют, приливают 2,5 см3 0,01%-ного раствора кристаллического фиолетового, разливают во флаконы или пробирки и вновь стерилизуют при температуре 100ºС в течение 30 мин. Экстракт хранят в холодильнике при температуре 4-6ºС до двух недель.
3.1.12. Приготовление среды Киллиана
К 100 см3 стерильного питательного бульона (рН 6,8-6,9) стерильно добавляют 1 см3 0,1%-ного раствора бриллиантовой зелени. Раствор бриллиантовой зелени готовят следующим образом: 0,1 г бриллиантовой зелени заливают 100 см3 дистиллированной воды, помещают во флаконы с резиновой или корковой пробкой и помещают в термостат при температуре 37 ºС на сутки.
3.1.13. Приготовление трехсахарного агара с мочевиной (Крумвиде-Олькеницкого в модификации Ковальчука)
В 1000 см3 дистиллированной воды растворяют 2 г глюкозы, 3,5 г сахарозы, 15 г лактозы, 0,6 г соли Мора, 1 г серноватистокислого натрия и 10 г мочевины. Соль Мора и серноватистокислый натрий предварительно растворяют в 5-7 см3 дистиллированной воды в пробирках. Углеводы и мочевину также растворяют в 10 см3 дистиллированной воды в колбе на водяной бане. До стерилизации устанавливают рН 7,4-7,6 и добавляют 46 г сухой среды с сахарозой и индикатором «ВР». Раствор размешивают и кипятят до расплавления агара, разливают в пробирки по 5-6 см3 в каждую. Среду, разлитую в пробирки, стерилизуют текучим паром 2 дня по 30 мин или при температуре 112 ºС в течение 20 мин. После стерилизации среду скашивают так, чтобы остался небольшой столбик (не менее 3 см).
3.1.14. Приготовление пептонно-углеводных сред (среды Гисса)
К 100 см3 дистиллированной воды прибавляют 1 г сухого ферментативного пептона, 0,5 г хлористого натрия и нагревают до растворения, затем фильтруют до тех пор, пока раствор не станет совершенно прозрачным. Устанавливают рН 0,7, прибавляют 0,5 г углевода и 1 см3 индикатора Андреде.
Среду разливают по 5 см3 в пробирки с поплавками и стерилизуют 20 мин при температуре 110 ºС. Среда должна быть бесцветной или соломенно-желтого цвета, без розового оттенка. Можно использовать готовые среды Гисса.
Для приготовления индикатора Андреде к 100 см3 дистиллированной воды добавляют 16,4 см3 1 моль/дм3 раствора гидроокиси натрия и 0,5 г кислого фуксина. Раствор стерилизуют 5 мин при температуре 110-112 ºС. Индикатор хранят в склянке из темного стекла.
(Измененная редакция. Изм. № 2).
3.1.15. Приготовление пептонной воды
К 1000 см3 дистиллированной воды добавляют 10 г пептона и 5 г хлористого натрия, кипятят до растворения пептона, фильтруют и устанавливают рН 7,2-7,4, после чего стерилизуют 30 мин при температуре 120 ºС.
3.1.16. Приготовление плазмы крови
В пробирку вносят 2 см3 5%-ного раствора лимоннокислого натрия и 8 см3 только что полученной крови кролика. Цитратную кровь ставят на 18-20 ч в холодильник при температуре 4-6ºС или подвергают центрифугированию при 3000 об/мин в течение 15 мин. В результате чего над осадком эритроцитов образуется прозрачный слой жидкости желтоватого цвета – плазмы, которую разводят физиологическим раствором 1:4.
3.1.17. Приготовление дефибринированной крови
В колбу со стеклянными бусами сливают 8 см3 только что взятой крови кролика, барана, лошади и непрерывно встряхивают в течение 10-15 мин. в результате чего находящийся в крови фибрин выпадает в осадок, обволакивает бусы. Дефибриниронанную кровь сливают в другую колбу или пробирку Слитая дебетированная кровь утрачивает способность свертываться.
3.1.18. Приготовление кровяного агара
К 100 см3 расплавленного стерильного мясо-пептонного агара, приготовленного по п. 3.1.1 и охлажденного до температуры 45 º С стерильно прибавляют 5-10 см3 стерильно взятой дефибринированной крови. Готовую среду разливают в стерильные чашки Петри, дают ей застыть и подсушивают в термостате при температуре 37 ºС. Слой агара должен быть равномерно окрашен в красный цвет.
3.1.19. Приготовление агара Симмонса
В 1000 см3 дистиллированной воды растворяют 5 г хлористого натрия, 0,2 г сернокислого магния, 1,5 г фосфорнокислого натрия-аммония, 2 г двузамещенного фосфорнокислого калия, 5 г нейтрального лимоннокислого натрия, 20 г агара. Раствор фильтруют, добавляют 40 см3 раствора бромтимолового синего (1:500). Среду разливают в пробирки по 5-6 см3 в каждую, стерилизуют при температуре 120ºС в течение 20 мин. после чего скашивают. Готовая среда должна быть оливкового цвета.
3.1.20. Приготовление среды Государственного контрольного института (ГКИ)
В стерильную колбу наливают 60 см3 раствора Хенкса и добавляют стерильно 40 см3 сыворотки крови крупного рогатого скота, прогретой при температуре 56 ºС в течение 30 мин. После тщательного перемешивания устанавливают рН 7,2 раствором двууглекислого натрия и разливают среду по 2 см3 в стерильные пробирки, которые закрывают стерильными резиновыми пробками. Среду можно хранить при температуре 4 ºС до четырех месяцев.
3.1.21. Приготовление среды Дрожжевкиной
К 10 см3 стерильного желтка куриного яйца добавляют 90 см3 физиологического раствора, тщательно перемешивают. Смесь разливают по 8 см3 в стерильные пробирки. Перед употреблением проверяют стерильность среды, поместив ее в термостат при температуре 37 ºС на 48 ч.
3.1.22. Приготовление среды Китт-Тароцци
Свежую печень крупного рогатого скота разрезают на куски массой по 50-60 г, заливают равным количеством воды и кипятят в течение 30 мин при постоянном помешивании. Печеночный экстракт фильтруют через ватно-марлевый фильтр и смешивают с мясо-пептонным бульоном из расчета одна часть печеночного экстракта на три части бульона. Смесь нагревают до кипения, добавляют хлористый натрий из расчета 1,25 г на 1000 см3 среды и устанавливают рН 7,6-7,8, после чего кипятят в течение 15 мин и фильтруют через бумажный фильтр.
В пробирки кладут мелко нарезанные кусочки печени по 1,5-2 г и заливают смесью печеночного экстракта с мясо-пептонным бульоном. На поверхность среды наслаивают 0,5-1 см3 вазелинового масла. Среду стерилизуют в течение 30 мин при температуре 120ºС.
3.1.23. Разведение пенициллина
На каждые 100 тыс. ед. пенициллина добавляют 1 см3 стерильной дистиллированной воды и получают основное разведение, содержащее 100 тыс. ед. пенициллина в 1 см3. Например, во флакон, содержащий 500 тыс. ед. пенициллина, нужно внести 5 см3 дистиллированной воды.
В пять пробирок наливают по 4,5 см3 в каждую стерильной дистиллированной воды. В первую пробирку стерильной пипеткой вносят 0,5 см3 пенициллина основного разведения и получают в первой пробирке разведение, содержащее 10 тыс. ед. пенициллина в 1 см3 раствора. Новой пипеткой из первой пробирки, тщательно перемешав содержимое, переносят 0,5 см3 раствора во вторую пробирку и получают разведение, содержащее 1000 ед. пенициллина в 1 см3 раствора. Таким же образом из второй пробирки переносят в третью 0,5 см3 и получают разведение, содержащее 100 ед. пенициллина в 1 см3 раствора. Из третьей пробирки переносят 0,5 см3 в четвертую и получают разведение, содержащее 10 ед. в 1 см3 раствора. Из четвертой пробирки переносят 0,5 см3 в пятую и получают в пятой пробирке разведение, содержащее 1 ед. пенициллина в 1 см3 раствора.
3.1.24. Приготовление мясо-пептонного агара с пенициллином
В три колбочки или большие пробирки, содержащие по 20 см3 стерильного расплавленного и охлажденного до температуры 45-50 ºС мясо-пептонного агара (рН 7,2) добавляют в первую колбу 1 см3 пенициллина из четвертой пробирки (см. п. 3.1.23), содержащей в 1 см3 10 ед. пенициллина, тщательно перемешивают, получают агар, содержащий 0,5 ед. пенициллина в 1 см3, во вторую колбу вносят 1 см3 из пятой пробирки (см. п. 3.1.23), содержащей в 1 см3 1 ед. пенициллина, получают агар, который содержит в 1 см3 0,05 ед. пенициллина; третью колбочку оставляют без пенициллина для контроля. Содержимое всех трех колбочек разливают в стерильные пробирки по 5 см3 в каждую и скашивают.
3.1.25. Приготовление индикаторной бумаги для определения индола
5 г парадиметиламидобензальдегида, 10 см3 очищенной концентрированной фосфорной кислоты растворяют в 50 см3 96 º спирта. В тепловатом растворе смачивают фильтровальную бумагу, высушивают, нарезают узкими полосками. Цвет бумаги – желтый. При наличии индола цвет бумаги меняется от сиреневато-розового до интенсивно малинового. Появление других цветов на индикаторной бумаге не учитывают.
3.1.26. Приготовление индикаторной бумаги для определения сероводорода
В 100 см3 дистиллированной воды растворяют 20 г уксуснокислого свинца и 1 г двууглекислого натрия. Этим раствором пропитывают полоски фильтровальной бумаги, высушивают их при температуре 18-23 ºС и нарезают на узкие полоски. После приготовления бумага остается белой: при наличии сероводорода чернеет.
3.1.27. Приготовление насыщенного спиртового раствора метиленовой сини
В 100 см3 96º этилового спирта растворяют 8-9 г метиленовой сини. Раствор фильтруют.
3.1.28. Приготовление водно-спиртового раствора метиленовой сини
К 30 см3 дистиллированной воды добавляют 1 см3 насыщенного спиртового раствора метиленовой сини, приготовленной по п. 3.1.27.
3.1.29. Приготовление метиленовой сини Леффлера
К 100 см3 дистиллированной воды добавляют 30 см3 насыщенного спиртового раствора метиленовой сини и 1 см3 1%-ного раствора гидроокиси калия.
3.1.30. Приготовление насыщенного спиртового раствора фуксина
8-9 г основного кристаллического фуксина высыпают во флакон, заливают 100 см3 96º этилового спирта и ставят на 18-24 ч в термостат с температурой 37 ºС. Флакон периодически взбалтывают. В течение указанного времени значительная часть краски растворяется, и на дне флакона остается осадок, свидетельствующий о насыщении раствора.
Насыщенный раствор хранят во флаконах из темного стекла. Из насыщенного спиртового раствора готовят водно-спиртовой раствор фуксина. Для этого к 1 см3 насыщенного раствора добавляют 9 см3 дистиллированной воды.
3.1 31. Приготовление карболового фуксина Циля
1 г основного кристаллического фуксина растирают в ступке с 5 г кристаллической карболовой кислоты (фенола) и 0,5 см3 глицерина. Во время растирания небольшими порциями прибавляют 10 см3 96º этилового спирта. После того, как краска полностью разотрется, прибавляют при постоянном помешивании 100 см3 дистиллированной воды. Раствор краски фильтруют. Фуксин Циля стойкий и его хранят во флаконах из темного стекла с притертой пробкой.
3.1.32. Приготовление карболового кристаллического фиолетового, генциан-фиолетового или метилового фиолетового для окраски по Граму
1 г кристалл-, генциан- или метилвиолета растирают в ступке с 2 г кристаллической карболовой кислоты (фенола). Во время растирания небольшими порциями прибавляют 10 см3 96º этилового спирта. После того, как краска полностью растворится, прибавляют при постоянном помешивании 100 см3 дистиллированной воды. Раствор краски фильтруют через бумажный фильтр. Растворы нестойкие.
3.1.33. Приготовление красящей бумаги по Синеву
В 100 см3 96º этилового спирта растворяют 1 г кристаллвиолета и 1 см3 глицерина. Краску наливают в лоток. Бумагу нарезают полосками шириной 2,0-2,5 см и длиной 30-50 см. Полоску погружают на несколько секунд в краску так, чтобы она окрасилась с обеих сторон. Окрашенные полоски вынимают пинцетом, дают краске стечь и подвешивают на шпагате для высушивания. Бумагу сушат на воздухе при комнатной температуре 18-23 ºС. Высушенные полоски бумаги разрезают на кусочки размером 2 ∙ 2 см и хранят в банке из темного стекла.
3.1.34. Приготовление раствора Люголя
В 10 см3 дистиллированной воды растворяют 2 г йодистого калия. Затем прибавляют 1 г кристаллического йода. Раствор выдерживают 5-6 ч до полного растворения йода, после чего прибавляют 290 см3 дистиллированной воды. Хранят раствор в склянке из темного стекла.
3.2. Окраска препаратов
3.2.1. Окраска мазков по Граму (общепринятая модификация)
На фиксированный мазок помешают полоску фильтровальной бумаги и наливают карболовый генцианвиолет. Выдерживают 1-2 мин. после чего снимают бумажку, сливают краску, мазок промывают водой и наливают на него раствор Люголя (мазок чернеет). Через 1-2 мин раствор сливают и наливают этиловый спирт на 0,5-1 мин. Затем мазок промывают водой и дополнительно окрашивают водным фуксином или водным раствором сафранина в течение 1-2 мин. Затем промывают водой и просушивают мазок фильтровальной бумагой.
Окраску по Граму можно применять в видоизменении Синева, согласно которому вместо карболового генцианвиолета применяют окрашенные полоски фильтровальной бумаги, приготовленной по п. 3.1.33. Для окрашивания мазков на фиксированный мазок накладывают полоску фильтровальной бумаги, пропитанной спиртовым раствором кристаллвиолета, и наносят две-три капли воды, которые полностью впитываются бумагой, последняя плотно прилегает к стеклу. Выдерживают 2 мин., затем бумагу удаляют пинцетом и дальнейшую окраску производят по Граму.
3.2.2. Окраска капсул методом Ольта
Мазки окрашивают 2%-ным водным раствором сафранина в течение 1-3 мин (лучше при подогревании) и быстро смывают водой. Раствор сафранина готовят перед употреблением: сафранин растворяют в воде, доведенной до кипения, и фильтруют через бумажный фильтр.
3.2.3. Окраска капсул методом Ребигера
Мазки окрашивают и фиксируют одновременно. Готовят раствор: 15-20 г генцианвиолета растворяют в 100 см3 40%-ного формалина. Раствор оставляют на 8-10 ч при температуре 20ºС, фильтруют, после чего он готов к употреблению. Окрашивают нефиксированные мазки в течение 15-20 с, быстро промывают водой и высушивают фильтровальной бумагой.
3.3 Подготовка образцов к исследованию и проведение посева
- Каждый представленный к исследованию образец (мышцы, лимфатические узлы, паренхиматозные органы) перед посевом освобождают от видимой жировой и соединительной ткани, погружают на 2-3 мин вспирт и два раза обжигают с поверхности. Затем стерильными ножницами из глубины различных мест каждого образца вырезают кусочки размером не менее 2,0 ∙ 1,5 ∙ 2.5 см; лимфатические узлы разрезают пополам. Затем все вырезанные кусочки измельчают стерильными ножницами
- Для посева составляют две пробы по 15 г каждая. Одна проба состоит из кусочков мышц и лимфатических узлов, а вторая – из кусочков паренхиматозных органов (печени, почки и селезенки).
3.3.3. Каждую пробу в отдельности помещают в стерильный стакан (колбу) гомогенизаторa для приготовления взвеси. Для этого в стакан (колбу) добавляют по 15 см3 физиологического раствора, количество которого равно массе каждой пробы, и гомогенизируют пробы в электрическом гомогенизаторе. Вначале измельчают материал замедленной частотой оборотов, затем с большей частотой оборотов не более 2,5 мин (в зависимости от числа оборотов).
1 см3 приготовленной взвеси содержит 0,5 г продукта.
- Полученные взвеси отстаивают 10 мин. Из верхней части надосадочной жидкости пипеткой Пастера или петлей вносят на чашку с мясо-пептонным агаром и элективной средой (Эндо, Левина) одну-две капли или одну петлю и тщательно втирают материал в поверхность предварительно подсушенных сред.
- Одновременно с посевом на плотные среды производят посев материала для накопления сальмонелл в одну из сред обогащения (селенитовый Ф-бульон. Мюллера, Кауфмана, Киллиана, хлористомагниевую среду «М»). Для этого 20 см3 взвеси из мышц и лимфатических узлов вносят в один флакон (колбу), а 20 см3 взвеси из паренхиматозных органов – в другой. В каждый флакон наливают но 50 см3 среды обогащения.
При отсутствии гомогенизатора допускается посев кусочка пробы размером не менее 2,0 ∙ 1,5 ∙ 2,5 см (путем нанесения отпечатков разными сторонами пробы на поверхность питательной среды в чашках с предварительно подсушенным мясо-пептонным агаром и элективной средой (Эндо, Левина). При этом необходимо произвести также посев на элективные среды из лимфатического узла печени или соскоба с внутренней стенки желчного пузыря. Посев в среду обогащении производят во флаконы Сокслета (колбы), в которые предварительно налито по 50 см3 среды обогащения (селенитовой Ф-бульон, Мюллера, Кауфмана, Киллиана. хлористомагниевая среда «М»). В один флакон вносится измельченная проба из мышц и лимфатических узлов массой 10 г, а в другой – 10 г из паренхиматозных органов.
Следует иметь в виду, что на селенитовом Ф-бульоне S. typhi suis и S. cholerae suis, как правило, не растут. Наилучший рост S. cholerae suis наблюдается на среде Киллиана.
3.3.6. Посевы помещают в термостат при температуре 37 º С. Через 18 ч чашки с первичными посевами на плотных средах извлекают из термостата и просматривают визуально, при необходимости – через лупу или под малым увеличением микроскопа.
При отсутствии роста через 18 ч посевы выдерживают в термостате дополнительно до 24 ч.
На мясо-пептонном агаре отыскивают колонии, характерные для сибирской язвы, рожи, пастереллеза, листериоза, кокковых инфекций и др.
На чашках с элективными средами (Эндо, Левина) отыскивают колонии, характерные для бактерий семейства кишечных.
При обнаружении в мазках микробов, подозрительных на сибирскую язву, посевы на элективную среду и среду обогащения не производят.
4. ПРОВЕДЕНИЕ ИССЛЕДОВАНИЙ
4.1. Бактериоскопическое исследование
Из паренхиматозных органов (печени, почек, селезенки), лимфатических узлов туши или из пораженных участков органа и ткани приготовляют 2-10 мазков-отпечатков (в зависимости от характера патологических изменений и предполагаемого диагноза).
Препараты высушивают на воздухе, фиксируют и окрашивают одновременно и по Гриму и 2%-ным раствором сафранина или раствором Ребигера.
При бактериоскопии мазков прежде всего обращают внимание на наличие возбудителя сибирской язвы.
При окраске сафранином сибиреязвенные бациллы окрашиваются в кирпично-красный цвет, а капсулы, тени (следы распада бактерий) – в светло-желтый.
При окраске раствором Ребигера сибиреязвенные бациллы окрашиваются в темно-фиолетовый цвет, а капсулы – в красно-фиолетовый.
В мазках из лимфатических узлов или других тканей свиней, крупного рогатого скота при очаговом поражении, наряду с типичными капсульными палочками, могут обнаруживаться атипичные бациллы сибирской язвы в виде сильно изогнутых или перекрученных длинных нитей, разбухших и потерявших правильные контуры, или распавшихся на отдельные, как бы осколки бацилл или теней различной величины, отрицательно окрашивающихся по Граму или в виде конгломерата капсул, наполненных мельчайшими включениями.
Наличие в мазках грамположительных палочек с обрубленными концами, а при окраске сафранином или раствором Ребигера – палочек или цепочек, с капсулами или теней в мазках из лимфатических узлов свиней со специфической для сибирской язвы патологической картиной, дает предварительное заключение об обнаружении (бактериоскопически) микробов, характерных для возбудителя сибирской язвы.
При наличии в мазках атипичных бацилл одновременно с бактериоскопией ставят реакцию преципитации.
В зависимости от результатов бактериоскопии и характера роста на питательных средах проводят исследования на наличие определенных микробов.
4.2. Методы выявления аэробных бактерии
4.2.1. Выявление бацилл сибирской язвы
4.2.1.1 Сущность метода выявления бацилл сибирской язвы заключается в определении их характерной морфологии, в определении характера роста на питательных средах и выявлении патогенности путем заражения лабораторных животных.
4.2.1.2. Проведение исследования
Бацилл сибирской язвы обнаруживают в три последовательных этапа: бактериоскопия мазков из патологического материала; получение и изучение свойств чистой культуры на питательных средах; биологическая проба на лабораторных животных и, при необходимости, серологическое исследование.
При бактериоскопии мазков из патологического материала обращают внимание на форму и расположение отдельных микробов и наличие капсул. Характерный вид сибиреязвенных палочек и обилие их в мазке нередко позволяет поставить диагноз уже по результатам бактериоскопического исследования.
Бациллы сибирской язвы на чашках с мясо-пептонным агаром через 16-24 ч растут в виде серо-белых шероховатых с бахромчатыми краями колоний, напоминающих под лупой или при малом увеличении микроскопа «головку медузы», «львиную гриву». Из подозрительной колонии делают посев в пробирку с мясо-пептонным бульоном.
На мясо-пептонном бульоне сибиреязвенные бациллы растут в виде крупных хлопьев, оседающих на дно пробирки к концу первых суток, с образованием осадка, напоминающего комок ваты, бульон остается прозрачным.
Из бульонной культуры готовят препарат «раздавленная» или «висячая капля». При микроскопировании препарата обнаруживаются неподвижные сибиреязвенные палочки.
При необходимости дифференциации сибиреязвенных бацилл от сапрофитных бацилл, которые морфологически очень сходны, выделенную чистую культуру на мясо-пептонном агаре или мясо-пептонном бульоне исследуют: на тест «жемчужное ожерелье», чувствительность к сибиреязвенному фагу, свертываемость желтка куриного яйца, гемолитическую активность, капсулообразование.
Тест «жемчужное ожерелье» осуществляют одним из двух способов:
Первый способ. Постановку теста начинают с разведения пенициллина по п. 3.1.23. В три пробирки с мясо-пептонным агаром, в каждой из которых содержится по 0,5 и 0,05 ед. пенициллина в 1 см3 (по п. 3.1.24), и в контрольную пробирку без пенициллина вносят по 0,25 см3 трехчасовых бульонных культур испытуемых штаммов, выращенных в термостате при температуре 37 ºС. Посевы помещают в термостат в наклонном положении (на деревянную рейку или стеклянную трубку) при температуре 37ºС. Через 3 ч из конденсационной жидкости берут бактериологической петлей материал и готовят на предметных стеклах мазки, которые высушивают на воздухе, фиксируют в течение 15 мин спирто-эфирной смесью и окрашивают метиленовой синью, разведенным фуксином или по Граму.
Второй способ. К мясо-пептонному бульону (рН 7,2-7,4) стерильно добавляют 20% сыворотки крови крупного рогатого скота без консерванта. Для этого берут три пробирки, в каждой из которых содержится по 8 см3 мясо-пептонного бульона, и добавляют в каждую пробирку 2,0 см3 сыворотки крови крупного рогатого скота. В первую пробирку добавляют 0,5 см3 пенициллина, содержащего 10 ед. в 1 см3 раствора, получают бульон, содержащий в 1 см3 0,5 ед. пенициллина; во вторую пробирку добавляют 0,5 см3 пенициллина из пробирки, содержащей 1 ед. пенициллина в 1 см3 раствора; в третью пробирку пенициллина не добавляют, в ней остается мясо-пептонный бульон с сывороткой крови (контрольная). Бульон с сывороткой крови и пенициллином разливают в стерильные пробирки по 2,5 см3 и вносят в каждую из них по 0,25 см3 трехчасовой бульонной культуры, выращенной в термостате при температуре 37 ºС, испытуемых штаммов. Для контроля производят посев в бульон с сывороткой крови без пенициллина.
Мясо-пептонный бульон перед посевом нагревают на водяной бане до температуры 40ºС, и засеянные пробирки выдерживают в термостате при температуре 37 ºС в течение 3-6 ч.
Дальнейший ход исследования проводят в той же последовательности, которая изложена в первом способе.
В случаях отрицательных результатов микроскопии через 3 ч инкубации посевов (на мясо-пептонном агаре и мясо-пептонном бульоне) следует продолжить инкубацию до 6 ч и после этого провести заключительный учет теста.
При положительной реакции теста «жемчужное ожерелье» бациллы сибирской язвы образуют цепочки шарообразной формы, которые приобретают сходство с ожерельем из бус. Споровые сапрофитные аэробные бактерии, как правило, не образуют шарообразных форм, а имеют обычную форму палочек, т.е. дают отрицательный результат при постановке этого теста.
Лизис сибиреязвенным фагом «Гамма МВА» осуществляют одним из двух способов:
Первый способ. На поверхности пластики с мясо-пептонным агаром (рН 7,2-7,4) в чашке Петри стерильной пробиркой с ровными краями делают 5-6 насечек. Бактериологической петлей или стерильной пастеровской пипеткой с тонко оттянутым концом на поверхность агара в центр насечки (кружка) наносят одну каплю трехчасовой бульонной культуры испытуемых штаммов. Внесенную каплю распределяют равномерно петлей по всей поверхности насечки. Засеянные чашки подсушивают в течение 15-20 мин при температуре 37ºС, после чего в центр каждого посева наносят каплю неразведенного фага, вновь подсушивают в течение 10 мин при температуре 37ºС, и затем чашки помещают в термостат при температуре 37ºС.
Через 6-8 ч в месте посева можно обнаружить стерильное пятно, в контрольных чашках все насечки покрыты культурой, как и в чашках, в которых испытывались сапрофитные спорообразующие аэробные бактерии.
Второй способ – способ «стекающей капли». Исследуемую культуру высевают в три пробирки на скошенный мясо-пептонный агар и выдерживают в термостате при температуре 37 ºС не более 20 мин. Пробирки ставят вертикально в штатив. Затем на верхнюю часть агара наносят каплю неразведенного бактериофага. Одну пробирку оставляют для контроля без фага. Действие фага устанавливают через 6-8 ч. В контрольной пробирке по всей поверхности агара наблюдается обычный рост культуры. В пробирках с фагом по ходу стекший капли микробы не растут, а вокруг этой зоны наблюдается обычный рост культуры в виде «бордюра».
Наиболее четко явление лизиса наблюдается через 16-18 ч.
Свертываемость желтка куриного яйца определяют следующим образом.
Испытуемую культуру высевают в пробирку со средой Дрожжевкиной, приготовленной по п. 3.1.21. Посевы помешают в термостат при температуре 37ºС на время от 8 до 24 ч. За указанное время сибиреязвенная палочка не вызывает коагуляцию желтка куриного яйца, а большинство спорообразующих аэробных бактерий коагулируют желток уже через 6-8 ч.
Гемолитическую активность определяют следующим образом.
Испытываемую культуру высевают на чашку с мясо-пептонным агаром с кровью или в пробирку бульона с кровью. Чашку или пробирку помещают в термостат при температуре 37 ºС на 20-24 ч.
При наличии бацилл сибирской язвы на чашке вырастают характерные колонии без гемолиза, бульон с кровью также не гемолизируется. При наличии других сапрофитных спорообразующих бацилл, в большинстве случаев, вокруг колоний образуется зона β-гемолиза и наступает гемолиз бульона с кровью.
Определение капсулообразования in vitro.
Испытуемую культуру петлей высевают в пробирку со средой «ГКИ», приготовленной по п. 3.1.20, пробирку помещают в термостат при температуре 37 ºС. Через 30-120 мин у отдельных сибиреязвенных палочек начинается капсулообразование, а через 16-18 ч все или большинство сибиреязвенных бацилл образуют капсулу. Со среды готовят мазки, фиксируют их 15 мин в метаноле и окрашивают синью Леффлера в течение 15 мин. При микроскопии обнаруживают синие палочки и нити, окруженные розовой капсулой.
Одновременно с бактериоскопией исходного материала в сомнительных случаях производят реакцию преципитации.
Постановка реакции преципитации
2 г материала мелко нарезают в пробирку и заливают 10 см3 карболизированного 0,5%-ного физиологического раствора. Если исследуют свежий материал, то его предварительно выдерживают в термостате в течение 18-24 ч при температуре 37ºС. Затем экстракт кипятят в течение 30-40 мин и фильтруют через асбестовую нейтральную вату до полной прозрачности. 0,25-0,3 см3 прозрачного экстракта вносят в узкую пробирку и под него подслаивают такое же количество преципитирующей сибиреязвенной сыворотки, профильтрованной через бумажный фильтр.
Реакция считается положительной, если на границе сыворотки и экстракта через 3-8 мин появляется преципитирующее кольцо; сомнительной, если оно появляется через 10-15 мин и отрицательной – при отсутствии кольца.
При проведении реакции преципитации контролем служат: заведомо сибиреязвенный антиген с сибиреязвенной преципитирующей сывороткой, нормальная сыворотка с исследуемым экстрактом и преципитирующая сыворотка с физиологическим раствором.
При первом контроле должно получиться белое кольцо, а при втором и третьем — кольцо отсутствует.
Постановка биологической пробы
Для постановки биологической пробы на животных часть исходного материала растирают в ступке со стерильным песком и небольшим количеством физиологического раствора. 0,5 см3 взвеси впрыскивают двум белым мышам под кожу в области спины.
При исследовании материала от свиней (подчелюстные лимфатические узлы) опытных животных заражают только полученной чистой культурой.
В случае гибели мышей, что обычно наблюдается через 24-72 ч, их вскрывают: из крови сердца, печени, селезенки и места заражения приготовляют мазки, а из органов делают посевы.
В материале из свиней на мясо-пептонном агаре колонии сибиреязвенных бацилл могут быть атипичными, ослабленной вирулентности или невирулентными, но обладающими всеми другими характерными признаками сибиреязвенных возбудителей.
4.2.1.3. Обработка результатов
Основанием для постановки диагноза на сибирскую язву являются: наличие в мазках из патологического материала капсулообразующих палочек, а из колоний грамположительных — неподвижных бацилл; характерный рост на питательных средах; положительная реакция преципитации и положительный результат биологической пробы.
4.2.2 Выявление бактерий рожи свиней, листериоза и пастереллеза
4.2.2.1. Сущность метода выявления бактерий рожи свиней, листериоза и пастереллеза заключается в определении специфического роста этих микроорганизмов на мясо-пептонном агаре и их дифференциации по морфологическим, культурным и биологическим свойствам.
4.2.2.2. Проведение исследования
Наличие роста на чашках с мясо-пептонным агаром мелких прозрачных колоний требует проведения исследований на присутствие бактерий рожи свиней, листериоза и пастереллеза. Из подозрительных колоний приготовляют мазки с окраской по Граму, исследуют на подвижность и производят посев на мясо-пептонный агар и мясо-пептонный бульон.
Дифференциальный диагноз рожи свиней и листериоза проводят в соответствии с показателями, указанными в табл. 1.
Таблица 1
| Наименование показателя | Характеристика бактерий | |
| рожи свиней | листериоза | |
| Мазки-отпечатки | Неспорообразующие, тонкие, прямые или слегка изогнутые палочки, иногда нити | Неспорообразующие. короткие палочки с закругленными концами. Располагаются поодиночке, попарно, в форме римской цифры V или в виде палисада |
| Рост на мясо-пептонном агаре | Мелкие росинчатые. прозрачные колонии | Мелкие росинчатые, прозрачные колонии. Через 2-3 суток наблюдается помутнение колонии |
| Рост на мясо-пептонном бульоне | Легкое помутнение, поднимающийся при встряхивании осадок | Небольшое помутнение с образованием слизистого осадка, поднимающегося при встряхивании в виде косички |
| Мазки из культуры | Короткие, прямые или слегка изогнутые палочки: при хроническом течении инфекции — как короткие тонкие палочки, так и удлиненные цепочки и нити | Короткие, прямые, овоидные палочки, иногда почти кокки, располагаются поодиночке или кучками |
| Окраска по Граму | Положительная | Положительная |
| Подвижность | Неподвижен | Подвижен в молодой 6-20 ч культуре, выращенной при температуре 20-22ºС |
| Проба на каталазу | Отрицательная | Положительная |
Для проведения пробы на каталазу к суточной культуре добавляют 1 см3 10%-ного раствора перекиси водорода.
Бактерии листериоза, выделяя каталазу, разлагают перекись водорода с образованием пузырьков газа.
При необходимости дополнительной дифференциации бактерий листериоза от бактерий рожи свиней применяют посевы: на желатин, на углеводную среду с салицином, на мясо-пептонный печеночный агар с 0,01% теллурита калия, на мясо-пептонный агар с кровью, а также ставят конъюнктивальную пробу на морских свинках.
Бактерии листериоза, в отличие от бактерий рожи свиней, на желатине дают медленный рост в виде узловатой нити с неровными краями и пушистыми отростками, желатин не разжижают, ферментируют салицин, вызывают ß-гемолиз на агаре с кровью, растут на мясо-пептонном печеночном агаре с 0,5% глюкозы, 3% глицерина и 0,01% теллурита калия в виде мелких черных колоний и вызывают кератоконъюнктивит у морских свинок.
Бактерии пастереллезов, выделенные из туш и из паренхиматозных органов, представляют собой единый род бактерии с одинаковыми морфологическими культуральными и ферментативными свойствами, но различающихся по вирулентным свойствам.
Дифференциальный диагноз пастереллеза проводят в соответствии с показателями, указанными в табл. 2.
Таблица 2
| Наименование показателя | Характеристика бактерии пастереллеза |
| Мазки-отпечатки из материала | Неспорообразующие, мелкие, биполярно окрашивающиеся палочки |
| Окраска по Граму | Отрицательная |
| Рост на мясо-пептонном агаре | Мелкие, росинчатые, слетка опалесцирующие прозрачные колонии, которые принимают через 2-3 суток серовато-белый цвет |
| Рост на мясо-пептонном бульоне | Равномерное помутнение с осадком |
| Мазки из культур | Биполярность почти всегда отсутствует |
| Подвижность | Неподвижны |
4.2.2.3. Обработка результатов
О наличии бактерий судят в соответствии с характеристиками табл. 1 и 2.
4.2.3. Выявление бактерий кокковой группы
4.2.3.1. Сущность метода выявления бактерий кокковой группы (стафилококков, стрептококков) заключается в определении морфологии, определении характера роста на питательных средах и способности отдельных стафилококков коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
4.2.3.2. Проведение исследований
Наличие на чашках с мясо-пептонным агаром мелких прозрачных или мутноватых колонии, иногда образующих различные пигменты, вызывает подозрение на присутствие возбудителей кокковых инфекций (диплококкоза, стафилококкоза, стрептококкоза).
Дифференциальный диагноз ставят на основании микроскопического исследования (грамположительные, неподвижные, неспорообразующие, круглые клетки, располагающиеся одиночно, цепочками, гроздями и в виде ланцетовидных диплококков), а также определения характера роста на питательных средах.
На мясо-пептонном бульоне стафилококки и диплококки дают равномерное помутнение с выпадением обильного осадка.
При росте стрептококков на бульоне с 2% глюкозы бульон остается прозрачным, а на дно пробирки выпадает осадок.
Патогенность стафилококков определяют реакцией коагулирования плазмы крови.
Плазму крови кролика, приготовленную по п. 3.1.16, разливают по 0,5 см3 в две стерильные пробирки, в одну пробирку вносят петлей суточную агаровую культуру испытуемого стафилококка, другая пробирка является контрольной. Внесенную культуру тщательно перемешивают, после чего обе пробирки помещают в термостат при температуре 37ºС. Пробирки осторожно, избегая встряхивания, просматривают. Результаты реакции коагуляции учитывают в течение 2-4 ч и через 24 ч. Штаммы стафилококка, продуцирующие фермент плазмокоагулазу, вызывают свертывание плазмы, вследствие чего она превращается в студнеобразную массу, не выливающуюся при перевертывании пробирки. Свертывание плазмы обозначается знаком «+» с указанием времени, в течение которого произошла реакция.
4.2.3.3. Обработка результатов
При получении положительной реакции плазмокоагуляции считается, что в мясе обнаружен патогенный стафилококк.
4.2.4. Выявление бактерий рода сальмонелл
4.2.4.1. Сущность метода выявления сальмонелл заключается в определении их характерного роста на элективных средах и установлении ферментативных и серологических свойств сальмонелл.
4.2.4.2. Проведение исследования
Выявление сальмонелл проводится в четыре последовательных этапа: первичный (прямой) посев, обогащение, посев со среды обогащения и подтверждение.
Первичный посев производится путем посева взвеси исследуемого материала на плотные элективные среды. Эти среды выдерживают в термостате при температуре 37ºС и исследуют на присутствие колоний, которые являются типичными или подозрительными на сальмонеллы.
На элективных средах сальмонеллы растут, образуя характерные колонии:
- на фуксин-сульфитном агаре (агаре Эндо) сальмонеллы растут в виде круглых, бесцветных или слегка розоватых прозрачных, или полупрозрачных колоний;
- на эозин-метиленовом синем агаре (агаре Левина) сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний.
Обогащение проводят путем посева на жидкие селективные среды. Эти среды выдерживают в термостате при температуре 37ºС. На селенитовом Ф-бульоне лучшей температурой для накопления сальмонелл является 43ºС. Пересев производят после обогащения из жидких сред на плотные селективные диагностические среды, которые после термостатирования при температуре 37ºС исследуют на присутствие колоний типичных или подозрительных на сальмонеллы.
На селективных средах сальмонеллы растут, образуя характерные колонии:
- на бактоагаре Плоскирева сальмонеллы растут в виде бесцветных колоний, но колонии более плотные и несколько меньшего размера, чем на среде Эндо;
- на висмут-сульфитном агаре сальмонеллы, как правило, растут в виде черных или коричневых колонии с характерным металлическим блеском. При этом наблюдается прокрашивание в черный цвет участка среды под колонией. Исключение составляют некоторые серологические типы из группы С, которые на этой среде растут в виде нежных светло-зеленых или крупных серовато-зеленых колоний.
Подтверждение наличия бактерий из рода сальмонелл проводят путем определения соответствующих биохимических и серологических свойств колоний.
В случае отсутствия роста бактерий сальмонелл при первичном (прямом) посеве на элективных средах, через 12-24 ч проводят высев на селективные среды со сред обогащения: из сред Мюллера, Кауфмана и Киллиана через 12-16 ч, из селенитового Ф-бульона и хлористо-магниевой среды «М» через 18-24 ч.
Содержимое флаконов перед пересевом тщательно перемешивают и высевают штрихом петлей диаметром 2,5-3 мм на чашку с висмут-сульфитным агаром, бактоагаром Плоскирева или агаром Эндо.
Посевы помещают в термостат на 18-24 ч при температуре 37ºС, а посевы на висмут-сульфитном агаре – на 48 ч.
При обнаружении на чашках роста подозрительных колоний исследуют три-пять колоний с каждой чашки.
Подозрительные колонии бактерий сальмонелл исследуют в следующем порядке: из части колоний приготовляют мазок и окрашивают по Граму, затем проводят исследование на подвижность.
Бактерии сальмонеллы, как и все бактерии семейства кишечных, представляют собой палочки с закругленными концами, неспорообразующие, в большинстве подвижные (S. pullorum и S. gallinarum неподвижные), окрашивающиеся по Граму отрицательно.
Оставшуюся часть колонии растирают в конденсационной воде скошенного агара или в одной-двух каплях добавленного к агару стерильного бульона. Полученная взвесь служит исходным материалом для дальнейшего исследования.
Часть взвеси испытывают в реакции агглютинации на предметном стекле. Реакцию ставят с поливалентной адсорбированной агглютирующей О-сывороткой групп A, В, С, D и Е. В качестве контроля применяют каплю физиологического раствора.
Для проведения реакции агглютинации на предметное стекло наносят каплю поливалентной адсорбированной сыворотки и рядом каплю физиологического раствора. Затем бактериологической петлей захватывают часть взвеси и растирают ее в капле сыворотки, начиная с края капли, постепенно захватывая всю каплю. Петлю обжигают, захватывают петлей еще взвеси и вносят в каплю физиологического раствора (контрольного), также растирая до получения равномерной взвеси.
При положительной реакции через 1-2 мин в капле сыворотки образуются хлопья или комочки, а сама жидкость просветляется, что особенно заметно при покачивании стекла.
В физиологическом растворе (контрольном) наблюдается равномерная муть.
При получении положительной реакции агглютинации с адсорбированной поливалентной сывороткой проводят реакцию агглютинации на стекле с адсорбированными монорецепторными О-сыворотками. Следует начинать с более распространенных групп В, С, D и Е, в частности, в группе В с IV, в группе D с IX, в группе С с VII, в группе Е с III, X.
При отрицательной реакции агглютинации с одной колонией дополнительно исследуют еще не менее трех-четырех колоний.
При характерном росте на дифференциальной среде, избирательной положительной реакции агглютинации с монорецепторной О-сывороткой и при наличии подвижных грамотрицательных палочек дается предварительное заключение о том, что выделенная культура относится к сальмонеллам.
Одновременно с реакцией агглютинации материал засевают на трехсахарный агар Крумвиде-Олькеницкого в модификации Ковальчука, приготовленной по п. 3.1.13.
Посев на трехсахарный агар делают сначала штрихом по скошенной поверхности, а затем уколом в глубину столбика. Среду инкубируют в термостате в течение 16-18 ч. При наличии сальмонелл янтарный цвет среды Крумвиде-Олькеницкого в модификации Ковальчука изменяется следующим образом: столбик — желто-бурый, скошенная поверхность цвет не изменяет. По наличию трещин и разрыву столбика агара устанавливают образование газа, по изменению окраски столбика (почернение) — наличие сероводорода.
Сальмонеллы, не образующие сероводорода, изменяют цвет столбика агара в желтый цвет. Бактерии, не относящиеся к сальмонеллам, расщепляющие мочевину, окрашивают столбик и скошенную поверхность в ярко-красный цвет, а бактерии, сбраживающие лактозу и сахарозу, изменяют цвет среды в синий.
Если культуры ферментируют лактозу и глюкозу с образованием газа и расщепляют мочевину, они не принадлежат к бактериям рода сальмонелл.
Культуры, не ферментирующие лактозу и сахарозу и не расщепляющие мочевину, но ферментирующие глюкозу (с образованием газа) подвергают дальнейшему исследованию, для чего культуру со среды Крумвиде-Олькеницкого в модификации Ковальчука исследуют с монорецепторной О-сывороткой (материал берут с верхней части скошенной поверхности). Затем эту культуру агглютинируют с монорецепторными Н-сыворотками, сначала с первой фазой, затем со второй фазой Н-ангигена, входящего в данную группу (для агглютинации с Н-сыворотками культуру берут ближе к конденсационной жидкости в пробирке, где особи более подвижны) и устанавливают серологический тип сальмонелл.
Если культуры дают отрицательные результаты агглютинации с монорецепторными О-сыворотками, но при характерном росте на элективной среде и соответствующих морфологических признаках (грамотрицательные подвижные палочки) делают посев на среды с углеводами:
в короткий пестрый ряд (включая среды с глюкозой, лактозой, сахарозой, маннитом). В бульон Хоттингера для определения образования индола и сероводорода под пробку в пробирку с бульоном помещают индикаторные бумажки, приготовленные по пп. 3.1.25 и 3.1.26.
Посевы выдерживают в термостате при температуре 37ºС в течение 18-20 ч., после чего их просматривают под микроскопом.
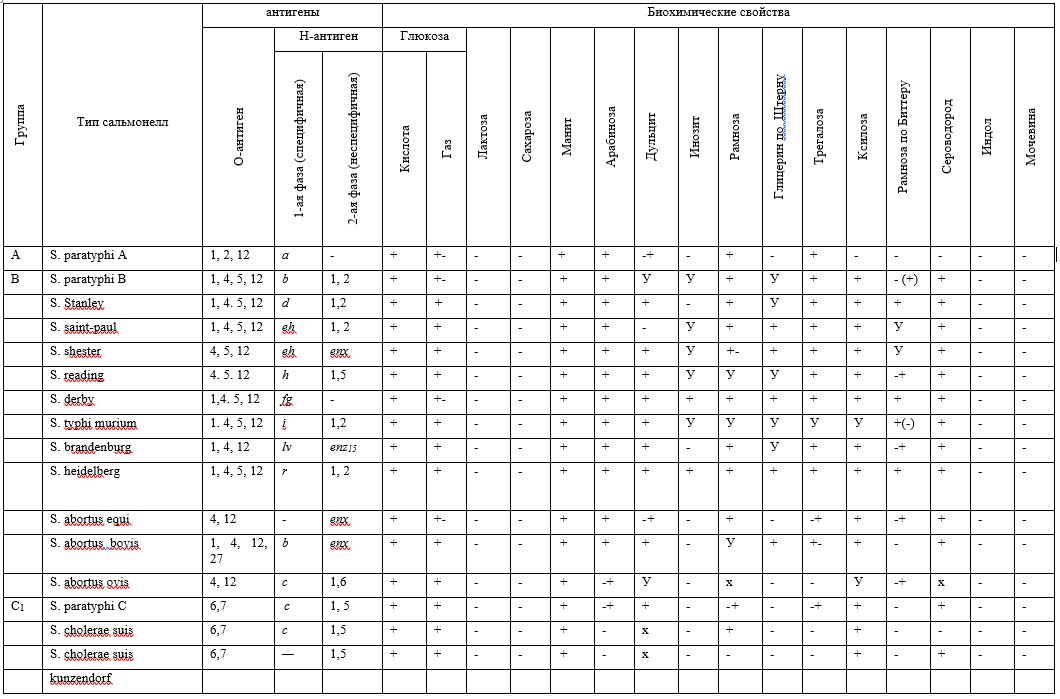
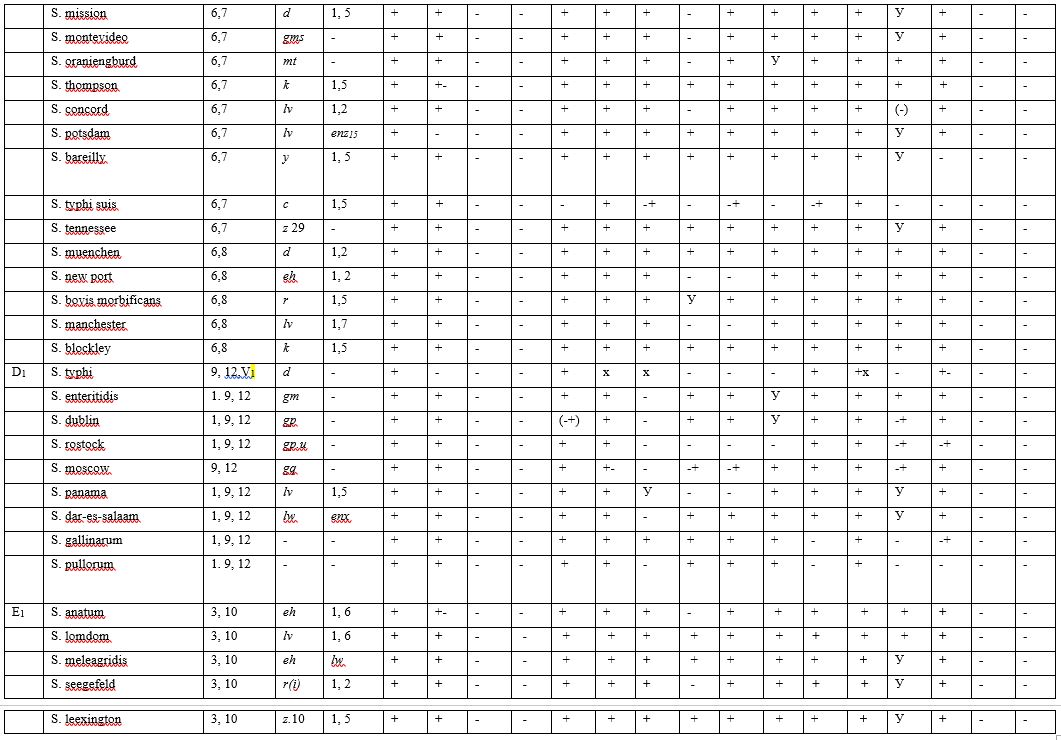
К бактериям из рода сальмонелл относятся бактерии, не ферментирующие лактозу и сахарозу и ферментирующие глюкозу и маннит (S. typhi suis не ферментирует маннит), образующие сероводород (S. cholerae suis и S. typhi suis сероводород не образуют) и не образующие индол.
При необходимости полной типизации сальмонелл проводят посев на расширенный пестрый ряд для определения биохимических свойств и исследуют их антигенные свойства (табл. 3).
Таблица 3
Условные обозначения:
«-» — отрицательный результат;
«-+» — отрицательный, иногда положительный результат;
«+» — положительный результат;
«+-» — положительный, редкие типы отрицательные;
«У» — различные биохимические типы;
«х» — поздний или непостоянный положительный, или отрицательный результат.
В случае выявления культур сальмонелл с отклонением от типичных свойств, для их окончательной идентификации при необходимости проводят дополнительные исследования.
Если культура обладает ферментативными свойствами, типичными дли сальмонелл, но не агглютинируется сальмонеллезными О- и Н-сыворотками, следует испытать ее способность лизироваться сальмонеллезным О-фагом.
Положительный результат реакции является дополнительным признаком, указывающим на принадлежность культуры к роду сальмонелл.
Для испытания культур на чувствительность к О-бактериофагу на пластинке хорошо подсушенного щелочного агара (рН 7,2-7,4) стерильной пробиркой с ровными краями делают 5-6 насечек. На каждую насечку наносят по две капли 4- или 18-часовой бульонной культуры испытуемого штамма с помощью тонкой оттянутой пастеровской пипетки или петли. Взамен бульонной культуры можно использовать взвесь суточной агаровой культуры на физиологическом растворе.
После подсыхания культуры на нанесенные капли петлей или пастеровской пипеткой меньшего диаметра наносят каплю О-бактериофага, на другую в качестве контроля наносят каплю бульона. Фаг наносят в разведении 10-кратном и 100-кратном (в зависимости от указанного на этикетке). На одной чашке можно испытывать одновременно 5-6 культур.
Чашки с нанесенными культурами и О-бактериофагом помещают в термостат при температуре 37ºС на 18-20 ч, после чего учитывают результаты. Положительный результат реакции определяется по появлению на месте нанесения фага четко очерченной зоны лизиса (сливного или отдельных негативных колоний), которая отчетливо видна невооруженным глазом. Отрицательный результат реакции определяют отсутствием лизиса; в местах нанесения фага имеет место рост культуры, как в контрольном месте.
О-фаг может быть использован также для предварительного испытания культуры. Для этого подозрительные колонии, выросшие на чашках с дифференциальной средой (Эндо, Плоскирева, висмут-сульфитным агаром и др.), снимают и пересевают на один из секторов чашки Петри со слабощелочным агаром. В центр каждого засеянного сектора тонкой пастеровской пипеткой или петлей наносят каплю О-фага, чашки помещают в термостат и на следующий день учитывают результаты.
4.2.4.3. Обработка результатов
Обнаружение подвижных (кроме S. pullorum и S. gallinarum) палочек, отрицательных по Граму, не ферментирующих лактозу и сахарозу, ферментирующих глюкозу и маннит с образованием кислоты и газа (S. typhi suis не ферментирует маннит), дающих положительную реакцию агглютинации с монорецепторными О- и Н-сальмонеллезными сыворотками, указывает на присутствие в мясе бактерий из рода сальмонелл.
4.2.5. Выявление бактерий из рода кишечной палочки — Эшерихий
4.2.5.1. Сущность выявления бактерий из рода кишечной палочки — Эшерихий заключается в определении морфологии, характера роста на элективных средах с лактозой и отсутствия способности образовывать цитохромоксидазу, утилизировать цитрат, образовывать сероводород и способности продуцировать индол.
4.2.5.2. Проведение исследования
Наличие роста на чашках с элективными средами (Эндо. Левина, Плоскирева) окрашенных колоний, вследствие ферментации ими лактозы и изменения цвета индикатора — лактозоположительных вариантов кишечной палочки (или не изменяющих цвета среды колоний лактозоотрицательных) требует их определения для установления присутствия их в мясе или паренхиматозных органах и дифференциации по биохимическим свойствам от других сходных бактерий из семейства кишечных.
На агаре Эндо бактерии кишечной палочки-Эшерихии растут в виде красных с металлическим блеском (или без блеска) розовых с красным центром или белых колоний: на эозин-метиленовом синем агаре (агаре Левина) — в виде темно-фиолетовых блестящих колоний; на бактоагаре Плоскирева — в виде кирпично-красных с глянцевой поверхностью колоний.
Из колоний, характерных для бактерий кишечной палочки-Эшерихии, готовят мазки, окрашивают по Граму и микроскопируют.
Бактерии кишечной палочки-Эшерихии — мелкие палочки с закругленными концами по Граму окрашиваются отрицательно.
Для определения подвижности культуры готовят препарат «раздавленная капля» и микроскопируют.
Бактерии кишечной палочки-Эшерихии чаще подвижны.
При наличии колоний, характерных для бактерий кишечной палочки-Эшерихии, их дифференцируют от других сходных микроорганизмов по биохимическим свойствам, указанным в табл. 4.
Таблица 4
| Биохимические дифференцирующие свойства | Род микроба | |||||||
| Биохимические варианты Escherichia | Proteus | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | Pr. vulgaris | Pr. mirabilis | |
| Образование сероводорода на трехсахарном агаре с двойной сернокислой солью закиси железа и аммония (солью Мора) | - | - | - | - | - | - | + | + |
| Образование газа на глюкозе на трехсахарном агаре с двойной сернокислой солью закиси железа и аммония (солью Мора) | + | - | + | - | + | - | + | + |
| Ферментация 10%-ной лактозы | + | + | + | + | - | - | - | - |
| Образование индола | + | + | - | - | + | + | + | - |
| Расщепление мочевины | - | - | - | - | - | - | + | + |
| Утилизация цитрата (на среде Симмонса) | - | - | - | - | - | - | Различно | Различно |
| Подвижность | +/- | +/- | +/- | +/- | +/- | +/- | + | + |
| Ферментации мальтозы | + | + | + | + | + | + | + | - |
| Ферментация маннита | + | + | + | + | + | + | - | - |
Условные обозначения:
«+» — положительный результат;
«-» — отрицательный результат;
«+/-» — положительный или отрицательный результат.
Для определения сероводорода испытуемую культуру засевают на трехсахарный агар, приготовленный по п. 3.1.13 уколом столбик, и помешают в термостат на 24 ч при температуре 37ºС.
Бактерии кишечной палочки-Эшерихии не образуют сероводорода, и столбик агара почернения не дает.
Для установления способности бактерий кишечной палочки-Эшерихии расщеплять мочевину, испытуемую культуру засевают на трехсахарный агар с мочевиной и выдерживают 24 ч в термостате при температуре 37ºС. Бактерии кишечной палочки Эшерихии не расщепляют мочевину и не изменяют цвет среды. При наличии бактерий, расщепляющих мочевину, реакция среды становится резко щелочной, и среда окрашивается в ярко-красный цвет.
Ферментацию лактозы устанавливают посевом испытуемой культуры кишечной палочки-Эшерихии в среду Гисса, содержащую 10 % лактозы, большинство бактерий кишечной палочки Эшерихии ферментируют 10%-ную лактозу.
Индол определяют при помощи индикаторной бумажки, приготовленной по п. 3.1.25, бактерии кишечной палочки-Эшерихии чаше образуют индол и окрашивают индикаторную бумажку в красный цвет.
Для определения способности утилизировать цитраты испытуемую культуру засевают на скошенный агар Симмонса, приготовленный по п. 3.1.19, посевы помещают в термостат на 24 ч при температуре 37ºС. Бактерии кишечной палочки-Эшерихии не растут на этой среде и не меняют ее цвета, бактерии, ассимилирующие цитрат, растут, подщелачивая среду и изменяя ее цвет из оливково-зеленого в синий.
4.2.5.3. Обработка результатов
Обнаружение отрицательных по Граму палочек, образующих характерные колонии на элективных средах с лактозой, ферментирующих 10%-ную лактозу, образующих индол, не расщепляющих мочевину, не ассимилирующих цитраты, не образующих сероводород, указывает на наличие бактерий кишечной палочки-Эшерихии.
4.2.6. Выявление бактерий из рода протей
4.2.6.1. Сущность метода выявления бактерий из рода протея заключается в определении морфологии, определении роста на питательных средах и способности гидролизовать мочевину, образовании сероводорода и отсутствии ферментации маннита.
4.2.6.2. Проведениеисследований
Наличие на средах в чашках вуалеобразного налета (Н-форма), при микроскопии которого обнаруживают полиморфные подвижные палочки, окрашивающиеся по Граму отрицательно, указывает на присутствие вульгарного протея; наряду с колониями, которые дают расплывающийся по поверхности рост, могут встречаться изолированные колонии средней величины, нежные полупрозрачные с розоватым центром, палочки из этих колоний лишены жгутиков и неподвижны (О-форма).
Для подтверждения наличия протея (Н-форма) производят посев в конденсационную воду скошенного агара (способ Шукевича).
Для обнаружения «нероящихся» О-форм производят посев на агар Плоскирева. О-форма протея растет на этой среде в виде прозрачных колоний, обладающих характерным запахом и слегка подщелачивающих среду, которая окрашивается около них в желтый цвет. Более старые колонии нередко мутнеют, а их центр принимает бурую окраску.
Биохимические свойства бактерий из рода протея приведены в табл. 4.
4.2.6.3. Обработка результатов
Обнаружение полиморфных грамотрицательных палочек, образующих характерный рост на средах Н-форма, подвижных (О-форма — неподвижные), ферментирующих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие бактерий из рода протея.
4.3. Метод ускоренного выявления возбудителей рожи свиней, листериоза, сальмонеллеза при помощи флуоресцирующих антител
4.3.1. Сущность метода заключается в определении способности антител иммунных сывороток при соединении через карбамидные группы со специальными красителями (флуорохромами) вступать в специфическую связь с соответствующими антигенами. Образующийся при этом комплекс «антиген-антитело» флуоресцирует и легко обнаруживается при люминесцентной микроскопии.
Метод может быть применен в качестве экспрессного и для ускоренной идентификации микробов.
Экспрессный метол проводится в начале исследования наряду с бактериоскопией и не требует выделения чистой культуры микробов из исследуемого материала. Полученный в течение 2-6 ч ответ является предварительным сигнальным, требующим подтверждения бактериологическим методом.
Применение метода люминесцирующих сывороток для идентификации выделенной культуры микробов имеет целью ускорение исследования, исключающего в ряде случаев определение культуральных и биохимических свойств, серологические реакции и типирование.
4.3.2. Аппаратура, материалы и реактивы
При проведении исследования применяют дополнительно аппаратуру, материалы и реактивы, кроме указанных в разд. 2:
микроскоп люминесцентный или люминесцентное устройство ОИ-17 с приставкой к биологическому микроскопу;
сыворотки против рожи свиней флуоресцирующие;
сыворотки против листериоза серотипов 1, 4а, 46, флуоресцирующие;
сыворотки флуоресцирующие групповые и комплексные сальмонеллезные;
сыворотка поливалентная сальмонеллезная;
сыворотка (меченая ФИТЦ) против гамма-глобулинов кролика, ослиная;
альбумин из крови крупного рогатого скота, меченый родамином;
масло нефлуоресцирующее иммерсионное или его заменитель, изготовленный из диметилфталата чистого - 100 см3, нафталина сублимированного – 1,75 г или тимола чистого – 5 г; глицерин с фосфатным буфером (в разведении 9:1 рН буфера 8,0);
раствор физиологический с фосфатным буфером, рН 7,4.
4.3.3. Подготовка к исследованию
Приготовление физиологического раствора с фосфатным буфером.
На аналитических весах отвешивают 9,078 г х.ч. однозамещенного фосфата калия, помешают его в мерную колбу и доводят дистиллированной водой до 1000 см3. Затем отвешивают 11,876 г двузамещенного фосфата натрия и в другой мерной колбе доводят дистиллированной водой да объема 1000 см3. При использовании двузамещенного фосфата натрия, содержащего 12 молекул воды, для получения 1000 см3 раствора берут навеску массой 23,752 г, а безводного реактива – 9,476 г. Для получения буфера с рН 7,4 смешивают четыре части раствора двузамещенного фосфата натрия и одну часть раствора однозамещенного фосфата калия. Полученный буфер добавляют к физиологическому раствору в соотношении 1:50.
Если при смешивании фосфатов (4:1) не получают рН 8.0, то изменяя соотношение растворов, достигают необходимой величины рН (при повышенной кислотности добавляют двузамещенный фосфат натрия, а при щелочном рН добавляют однозамещенный фосфат калия).
Если при добавлении буфера в соотношении 1:50 к физиологическому раствору последний будет иметь рН ниже 7.4, то увеличением количества добавленного буфера добиваются нужной реакции физиологического раствора.
4.3.4. Проведение люминесцентно-серологического исследования возбудителей рожи свиней и листериоза в культуре
Для исследования используют 18-24-часовые чистые или смешанные культуры, из которых готовят по три мазка на отдельных предметных стеклах. Один из мазков используют для обработки рожистой люминесцирующей сывороткой, два других — для обработки листериозными люминесцирующими сыворотками (серотипов 1, 4а, 46).
Перед применением флюоресцирующую сыворотку разводят физиологическим раствором с фосфатным буфером (рН 7.4) до рабочего разведения, указанного на этикетке ампулы. Сыворотки в рабочем разведении могут храниться при температуре 2-4ºС в течение 2 суток
Мазки готовят средней густоты (несколько десятков микробов в поле зрения микроскопа) размером не более 1 см2.
Место нанесения культуры очерчивают карандашом по стеклу с обратной стороны, подсушивают мазки на воздухе, маркируют и фиксируют этиловым спиртом в течение 15 мин.; мазки для фиксации погружают в вертикальном положении в стеклянный сосуд со спиртом. Каждое стекло отделяют металлической проволочкой или стеклянной соломкой.
После фиксации и испарения спирта мазки ополаскивают физиологическим раствором с фосфатным буфером (рН 7.4). На слегка подсушенный мазок наносят одну-две капли соответствующей люминесцирующей сыворотки в рабочем разведении.
Мазки с сывороткой помещают во влажную камеру (в чашки Петри с влажной фильтровальной бумагой на дне) и выдерживают в термостате при температуре 37ºС в течение 30 мин.
Допускается мазки ополаскивать физиологическим раствором или дистиллированной водой без фосфатного буфера.
Затем сыворотку отмывают, погружая мазки в кювету, содержащую физиологический раствор с фосфатным буфером рН 7.4 на 20 мин. Раствор в кювете периодически помешивают и меняют через 10 мин.
Отмытые мазки ополаскивают дистиллированной водой и высушивают на воздухе. Для быстроты высушивания можно использовать вентилятор.
4.3.4.1. На поверхность мазка наносят небольшую каплю глицерина с буфером рН 8,0, накрывают покровным стеклом, излишек глицерина удаляют.
На покровное стекло наносят нефлуоресцирующее иммерсионное масло или его заменитель и производят люминесцентную микроскопию.
4.3.4.2. Диагностическая оценка интенсивности свечения возбудителей рожи свиней и листериоза:
«++++» — яркая, сверкающая зеленая люминесценция морфологически типичных бактерий с более интенсивным свечением по их периферии (положительная);
«+++» — отчетливо выраженная, достаточно яркая, зеленоватая люминесценция морфологически типичных бактерий с более интенсивным свечением по их периферии (положительная);
«++» — недостаточно яркая желтовато-зеленоватая люминесценция, периферический ободок выявляется с трудом (сомнительная);
«+» — люминесценция очень слабая, морфология бактерий различается с трудом (отрицательная);
«—» — люминесценция отсутствует, видны лишь тени бактерий (отрицательная).
Видовую принадлежность обнаруженного возбудителя устанавливают по определенной сыворотке, которая вызывает специфическое свечение исследуемой культуры интенсивностью не менее чем на три креста.
4.3.5 Проведение люминесцентно-серологического исследования бактерий рожи свиней и листериоза в мясе и паренхиматозных органах
Материал для исследования должен быть свежим. Для люминесцентной микроскопии из паренхиматозных органов готовят взвесь на физиологическом растворе хлорида натрия в соотношении 1:5. После осаждения крупных частиц взвеси из разных участков ее поверхности готовят по два-три мазка на каждый вид сыворотки.
Обработку препаратов и люминесцентную микроскопию проводят так, как указано при исследовании культур (п. 4.3.4.1).
4.3.6. Диагностическая оценка интенсивности свечения бактерий рожи свиней и листериоза
При обнаружении возбудителя с типичной морфологией, специфическим свечением и интенсивностью не ниже чем на три креста, ставят положительный люминесцентно-серологический диагноз соответственно той сыворотке, которая вызвала свечение возбудителя.
При сомнительных или отрицательных результатах (слабое свечение на один или два креста, свечение микробов с атипичной морфологией или отсутствие свечения возбудителя в мазках) диагноз уточняют люминесцентной микроскопией культур, выделенных из посевов патологического материала.
4.3.7. Проведение люминесцентно-серологического исследования сальмонелл
Для исследования могут быть использованы мазки-отпечатки из органов и тканей, пробы мяса после подращивания в термостате в течение 4-6 ч, а также мазки, приготовленные из бактериальных культур (как чистых, так и смешанных).
Сухую флуоресцирующую сальмонеллезную сыворотку и альбумин, меченый родамином, перед применением растворяют каждый в отдельности дистиллированной водой в объеме, указанном на этикетке ампулы.
При использовании сыворотки совместно с альбумином для приготовления рабочей смеси, флуоресцирующую сальмонеллезную сыворотку и альбумин, меченый родамином, разводят каждый в отдельности 0,15 моль/дм3 раствором хлористого натрия (рН 7,2-7,4) на одно разведение меньше, чем их рабочие титры, указанные на этикетках препаратов. Разведенную флуоресцирующую сыворотку и альбумин, меченый родамином, смешивают в равных объемах. Рабочую смесь хранят в пробирке с плотной резиновой пробкой в темном месте при температуре 4ºС.
4.3.7.1. Проведение люминесцентно-серологического исследования сальмонелл в культуре прямым способом
Исследованию подлежат молодые, чистые или смешанные культуры, выращенные в жидких или лучше на плотных элективных средах после появления макроскопически видимого роста.
Из двух-трех типичных для сальмонелл колоний готовят мазки на предметных стеклах соответственно числу сывороток, которые должны быть применимы для исследования.
Препараты помещают в чашки Петри с влажной фильтровальной бумагой на дне, на каждый мазок наносят одну-две капли сыворотки в рабочем разведении или сыворотку с альбумином, меченым родамином, сыворотку распределяют по всей поверхности мазка и выдерживают при комнатной температуре в течение 30 мин. или в термостате при температуре 37ºС в течение 15 мин. Затем сыворотку отмывают дважды по 10 мин. 0,15 моль/дм3 раствором хлористого натрия. Отмытые мазки ополаскивают дистиллированной водой и высушивают на воздухе или в термостате.
Обработку и микроскопию мазков производят по п. 4.3.4.1.
4.3.7.2. Проведение люминесцентно-серологического исследования сальмонелл в мясе и паренхиматозных органах прямым способом
В свежих пробах при отсутствии патологических изменений типичные формы сальмонелл можно обнаружить в редких случаях. Поэтому люминесцентную микроскопию проводят после накопления сальмонелл. Для этого от всех органов отрезают кусочки размером 2 ∙ 3 ∙ 4 см и помещают их в закрытых чашках в термостат на 4-6 ч для подращивания; их исследуют при отрицательном результате первичной микроскопии.
Готовят две серии мазков-отпечатков (по три мазка в каждой серии). Одну серию мазков окрашивают по Граму и исследуют по общепринятой методике. Вторую серию окрашивают люминесцирующими сальмонеллезными сыворотками или смесью люминесцирующей сальмонеллезной сыворотки с альбумином, меченым родамином. Окраску ведут аналогично окраске сальмонелл в культуре.
Обработку и микроскопию производят по п. 4.3.4.1.
4.3.7.3. Диагностическая оценка интенсивности свечения сальмонелл
При микроскопии мазков из культуры или мазков-отпечатков из органов и тканей бактерии сальмонелл дают яркое изумрудно-зеленоватое свечение по периферии бактерий с хорошо выраженной центральной темной зоной. Фон препарата темный с оранжево-красным окрашиванием посторонней микрофлоры, тканевых элементов и других органических частиц (при применении альбумина, меченого родамином), содержащихся в исследуемых препаратах.
Характерное свечение контура (ободка) при визуальном осмотре оценивается в крестах:
«+ + + +» — сияющее зеленовато-желтоватое свечение;
«+ + +» — яркое желтовато-зеленоватое свечение;
«+ +» — умеренное желтовато-зеленоватое или беловатое свечение отчетливо заметного контура;
«+» — слабое беловатое свечение различимого контура;
«—» — клетки в виде сероватых теней, контур отсутствует или слабо заметен на отдельных участках периферии клеток (не у всех микробов).
4.3.7.4. Положительным результатом обнаружения сальмонелл считается свечение типичных для сальмонелл форм, оцениваемое не ниже чем на два креста при условии, что в контрольных препаратах, окрашенных рабочим разведением гетерологической сыворотки, оно оценивается отрицательно, а также при отрицательных результатах окрашивания сальмонеллезными флуоресцирующими сыворотками гетерологических бактерий (кишечной палочки, протея).
Свечение на один крест оценивается как сомнительное, и исследование повторяют.
4.3.7.5. Проведение люминесцентно-серологического исследования сальмонелл в культурах, мясе и паренхиматозных органах непрямым способом
Люминесцентно-серологическое исследование состоит из двух этапов.
Первый этап. Обработка мазков из культур, мазков-отпечатков иммунной сывороткой.
После фиксации мазков этиловым спиртом, на мазки из культур или мазки-отпечатки из мяса или органов наносят пастеровской пипеткой одну-две капли поливалентной сальмонеллезной сыворотки, разведенной физиологическим раствором 1:32. Мазки помещают в чашки Петри с влажной фильтровальной бумагой и выдерживают 30 мин. при комнатной температуре или 15 мин. при температуре 37ºС.
Несвязавшуюся иммунную сыворотку отмывают 5 мин. водопроводной водой, мазки высушивают на воздухе или в термостате при температуре 37ºС.
Второй этап. Окраска мазков из культур, мазков-отпечатков люминесцирующей сывороткой против гамма-глобулина кролика (меченого ФИТЦ) или смесью сыворотки с альбумином, меченым родамином.
При окраске смесью люминесцирующей сыворотки против гамма-глобулина кролика (меченого ФИТЦ) или смесью люминесцирующей сыворотки с альбумином, меченым родамином, готовят рабочую смесь, как указано в п. 4.3.7.
Обработку и микроскопию мазков производят по п. 4.3.4.1. Диагностическую оценку интенсивности свечения производят по п. 4.3.7.3.
4.4. Метод выявления анаэробных бактерий
4.4.1. Сущность метода выявления анаэробных бактерий заключается в определении их способности расти в отсутствии кислорода воздуха, морфологии возбудителей, роста на питательных средах и на выявлении патогенности возбудителей путем заражения лабораторных животных.
Удовлетворительные анаэробные условия создаются в жидкой питательной среде, где в качестве восстановителя применяют мясо, печень, которые одновременно служат и источником питания.
Среда должна быть фасована во флаконы или пробирки таким образом, чтобы площадь поверхности среды по абсолютной величине не превышала 1/10 ее объема, и поверхность ее была изолирована от кислорода воздуха.
Исследование на анаэробные бактерии проводят при подозрении на следующие заболевания: эмфизематозный карбункул (эмкар), злокачественный раневой газовый отек, брадзот овец, дизентерию ягнят, энтеротоксемию овец, столбняк, некробактериоз, ботулизм.
4.4.2. Проведение исследования
Материалом для исследования при эмкаре и злокачественном раневом газовом отеке являются кусочки пораженных мышц, отечные ткани, лимфатические узлы, печень и селезенка; при брадзоте овец — кровь из сердца, слизистая оболочка сычуга и тонкого отдела кишечника, инфильтрат подкожной клетчатки; при дизентерии ягнят и энтеротоксемии овец — содержимое кишечника, пораженная почка; при столбняке — раневой секрет, гной, кусочки тканей, которые берут из глубоких слоев пораженных участков; при некробактериозе — некротические фокусы паренхиматозных органов; при ботулизме — содержимое желудка, толстых кишок, селезенка, кусок печени и головной мозг.
Диагноз на анаэробные инфекции ставят на основании бактериоскопии, посева материала и биопробы на животных.
Для бактериоскопии из материала готовят несколько мазков или мазков-отпечатков, которые окрашивают метиленовой синью или по Граму.
При просмотре мазков обращают внимание на форму, расположение отдельных микробов, наличие и расположение спор, наличие капсул и отношение к окраске по Граму.
Для посева материал обжигают и навеску массой 10 г растирают в стерильной ступке с добавлением двойного количества физиологического раствора.
По 3-5 см3 приготовленной взвеси засевают в четыре большие пробирки с мясной средой типа Тароцци. залитой слоем вазелинового масла толщиной 0,5 см, предварительно прогретой в кипящей водяной бане в течение 20-30 мин., а затем быстро охлажденной до температуры не ниже 50ºС. Посевы перед термостатированием прогревают для всех указанных анаэробов две пробирки при температуре 80ºС в течение 20 мин.; при исследовании на Cl. botulinum типа Е одну пробирку при температуре 60ºС в течение 15 мин. (при этом сохраняются споры Cl. botulinum типа Е), а другую при 80ºС в течение 20 мин. Остальные пробирки оставляют непрогретыми.
При подозрении на Cl. botulinum для выявления типа Е две пробирки — одну непрогретую и одну прогретую при 60ºС выдерживают при температуре 28ºС. Другие две пробирки (непрогретую и прогретую при 80ºС) инкубируют при температуре 37ºС на другие анаэробные бактерии.
Термостатирование проводят в течение 5-10 суток; наблюдение за ростом производят ежедневно. При обнаружении роста производят микроскопическое исследование.
Морфология и характер роста на среде Китт-Тароцци отдельных патогенных анаэробных бактерий приведены в табл. 5.
Выделение чистой культуры производится по следующей методике (метод рассева по Вейону-Виньялю).
На мартеновском бульоне готовят полужидкий агар (0,5%) с 0,5% глюкозы и разливают в пробирки по 9 см3; агар подогревают до температуры 55ºС и производят посев в убывающем порядке: в первую пробирку засевают 1 см3 культуры из бульона Китт-Тароцци, во вторую — 1 см3 из первой пробирки, в третью — 1 см3 из второй и так до пятой пробирки.
Таблица 5
| Наименование анаэробных бактерий | Морфология | Характер роста на среде Китт-Тароцци | ||||
| Величина микробов, мкм | Формат палочек | Поло-жительность | споры | |||
| Длина | Ширина | Мазки из материала | Форма и расположение | |||
| Возбудитель шумящего карбункула Cl. Chauvoei | 2-8 | 0,5-1,0 | Спорообразующая полиморфная (веретенообразная, шаровидная, грушевидная), толстая с закругленными концами палочка, располагающаяся одиночно и парами | + | Овальная, центральное или субконцевое | Через 16-20 ч слабое равномерное помутнение, газообразование |
|
Анаэробные бактерии группы злокачественного раневого отека: Cl. septicum Cl. oedematiens. |
8-15 | 2,5-10 | Отдельные палочки с закругленными краями, нередко нити, особенно с поверхности печени | + | Овальная; центральное или субконцевое; свободно лежащее | Через 16-24 ч равномерное помутнение с газообразованиями, в дальнейшем бульон просветляется и на дне образуется хлопьевидный осадок |
| Типа А и В | 5-10 | 0,8-1,0 | Крупная полиморфная с закругленными концами палочка | + | Овальная; центральное или субтерминальное | Нежный рост со слабым газообразованием, через 18-24ч бульон просветляется, на дне хлопьевидный осадок |
| Cl. histolyticum | 2-5 | 0,5-0,8 | Тонкие палочки с закругленными концами; располагаются одиночно, парами или цепочками | + | Овальная; центральное или субтерминальное (форма игольного ушка) | Обильное равномерное помутнение с последующим образованием осадка, без газообразования |
| Cl. perfringens | 4-8 | 1,0-1,5 | Толстая палочка со слегка закругленными обрубленными концами. В организме животного образует капсулу | - | Овальная; центральное или субтерминальное | Через 5-6 ч появляется равномерное помутнение, бурное газообразование, через 48 ч среда просветляется |
| Cl. sordelii | 2-4 | 1,0-1,5 | Полиморфная палочка с закругленными концами, расположены по 2-3 членика, встречаются цепочки и нити | + | Овальная, располагается к концам | Интенсивное помутнение среды и газообразование, в старых культурах дает осадок, который тянется в виде слизистых нитей |
| Cl. sporogenes | 3-7 | 0,8-1,1 | Палочки с закругленными концами, быстро образуют споры | + | Овальная; центральное или субтерминальное | Обильный рост с газообразованием и неприятным гнилостным запахом |
| Возбудитель столбняка Cl. tetani | 3-10 | 0,4-0,8 | Палочки с закругленными концами | + | Круглая; концевое в виде барабанной палочки | Интенсивная муть, через 48-72 ч наступает просветление среды. Культура издает запах жженого рога |
|
А, В, С, D, Е, F (возбудитель ботулизма) Cl. botulinum |
2,6-10 | 0,3-0,8 | Толстая палочка с закругленными концами | + | Овальная; субтерминальное («теннисная ракетка»), реже центральное | Помутнение среды, газообразование, культура издает запах прогорклого масла |
| Возбудитель некробактериоза Bact. necrophorum | 0,5-1,0 полиморфная, нити различной длины, короткие палочки и даже формы кокков | Палочки и короткие нити обычно одинаковой толщины, зернистоокрашенные нити | - | Не образуют | Интенсивная муть, очень слабое газообразование | |
Обозначение:
«+» — подвижные;
«-» — неподвижные.
После тщательного перемешивания полученных разведений культуры из каждой пробирки среду насасывают в стеклянные трубки (длиной 20 см и диаметром 0,75 см), один конец которых закрыт вагой, а другой — оттянут. Среду насасывают на уровень не более 3/4 длины трубки, после чего оттянутый конец трубки запаивают (при запайке, во избежание разбрызгивания материала, нельзя держать противоположный конец зажатым).
Трубки со средой быстро остужают под струей холодной воды и помещают в термостат с температурой 37ºС. На 2-5 сутки посевы в трубках просматривают и отмечают рост отдельных колоний. Обычно анаэробные бактерии растут в глубоких слоях агара (ниже 1 см от верхнего края). При наличии газа столбик агара разрывается. В местах нахождения отдельной колонии трубку надпиливают, фламбируют над пламенем и разламывают. Колонию снимают петлей вместе с агаром и переносят в пробирку со средой Китт-Тароцци.
В случае необходимости изучают культурные и биохимические свойства выделенной чистой культуры.
Для биологической пробы используют исходный материал, а также культуру.
Заражение опытных животных производят тем же материалом, который используют для бактериологических посевов.
При подозрении на эмфизаматозный карбункул заражают внутримышечно морскую свинку взвесью в дозе 0.5-1 см3, которая погибает через 16-96 ч; при подозрении на злокачественный отек также заражают внутримышечно морскую свинку или мышь взвесью в дозе 1 см3, которая погибает через 12-24 ч посте инъекции; при подозрении на брадзот овец заражают подкожно иди внутримышечно морскую свинку, которая погибает через 1-2 суток; при подозрении на дизентерию ягнят и энтеротоксемию овец для внутримышечного заражения используют кроликов или морских свинок, которые погибают в течение первых суток; при подозрении на столбняк заражают фильтратом из культуры в дозе 0,5-0.8 см3 подкожно белых мышей в области корня хвоста, животные погибают на 3-4 сутки; при подозрении на некробактериоз заражение в дозе 0,5-1 см3 кроликов и белых мышей производят под кожу в области уха (кролик) или живота (мышь). На месте инъекции, особенно на ухе, появляются некрозы. Животные погибают через 5-10 суток, иногда они выживают.
Исследование на определение ботулизма (токсинообразование) проводят на белых мышах.
Нейтрализация токсина противоботулинической сывороткой
Используемый материал предварительно растирают в ступке со стерильным физиологическим раствором в соотношении 1:2, выдерживают при комнатной температуре 1-1,5 ч для экстрагирования токсина, затем настой фильтруют через ватно-марлевый фильтр или центрифугируют при 3000 об/мин в течение 15-20 мин.
Нейтрализация токсина: к 0,5-0,8 см3 фильтрата добавляют 0,2 см3 смеси диагностических моновалентных противоботулинических сывороток типов А, В, С, D, Е и F по 0,04 см3 каждого типа. Смесь выдерживают при комнатной температуре в течение 30 мин.
Двум мышам вводят по 0,5-0,8 см3 исследуемого фильтрата или центрифугaтa внутрибрюшинно или внутривенно (внутривенно вводят только центрифугат). Другим двум мышам вводят смесь фильтрата и сыворотки.
Аналогичное испытание может быть проведено с 6-7 суточной культурой, выращенной на печеночном бульоне.
В этом случае отсасывают пастеровской пипеткой верхний слой культуры, фильтруют через ватно-марлевый фильтр и далее поступают, как и при испытании настоя.
Если мыши, получившие фильтрат, необработанный противоботулинической сывороткой, погибают, результат биопробы положительный (в мясе имеется токсин). Мыши, которым вводилась смесь фильтрата с сывороткой (контрольные), выживают.
В случае гибели всех четырех мышей следует повторить реакцию нейтрализации с экстрактами, разведенными в 5, 10, 20 и даже 100 раз.
При обнаружении в испытуемом материале ботулинического токсина сразу же ставят развернутую реакцию нейтрализации для определения типа токсина с типоспецифическими диагностическими сыворотками.
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1 РАЗРАБОТАН И ВНЕСЕН Государственным агропромышленным комитетом СССР
2 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 14.11.75 № 3054
3 ВЗАМЕН ГОСТ 7269-54 в части раздела II
4 ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
| Обозначение НТД, на который дана ссылка | Номер пункта | Обозначение НТД, на который дана ссылка | Номер пункта | Обозначение НТД, на который дана ссылка | Номер пункта |
| ГОСТ 171—81 | 2.1 | ГОСТ 4328- 77 | 2.1 | ГОСТ 13739-78 | 2.1 |
| ГОСТ 195-77 | 2.1 | ГОСТ 4523-77 | 2.1 | ГОСТ 13805-76 | 2.1 |
| ГОСТ 245-76 | 2.1 | ГОСТ 5541-2002 | 2.1 | ГОСТ 16317-87 | 2.1 |
| ГОСТ 779-55 | 2.1 | ГОСТ 5556-81 | 2.1 | ГОСТ 17206-96 | 2.1 |
| ГОСТ 1027-67 | 2.1 | ГОСТ 5833-75 | 2.1 | ГОСТ 18300-87 | 2.1 |
| ГОСТ 1341-97 | 1.2 | ГОСТ 5962-67 | 2.1 | ГОСТ 20015-88 | 2.1 |
| ГОСТ 1770-74 | 2.1 | ГОСТ 6038-79 | 2.1 | ГОСТ 20729-75 | 2.1 |
| ГОСТ 1791-67 | 2.1 | ГОСТ 6253-78 | 2.1 | ГОСТ 20730-75 | 2.1 |
| ГОСТ 2493-75 | 2.1 | ГОСТ 6259-75 | 2.1 | ГОСТ 21239-93 | 2.1 |
| ГОСТ 2874-82 | 2.1 | ГОСТ 6552-80 | 2.1 | ГОСТ 21241-89 | 2.1 |
| ГОСТ 3164-78 | 2.1 | ГОСТ 6672-75 | 2.1 | ГОСТ 22280-76 | 2.1 |
| ГОСТ 4025-95 | 2.1 | ГОСТ 6691-77 | 2.1 | ГОСТ 24104-2001 | 2.1 |
| ГОСТ 4159-79 | 2.1 | ГОСТ 6709- 72 | 2.1 | ГОСТ 25336-82 | 2.1 |
| ГОСТ 4170-78 | 2.1 | ГОСТ 9147-80 | 2.1 | ГОСТ 25706-83 | 2.1 |
| ГОСТ 4198-75 | 2.1 | ГОСТ 9284-75 | 2.1 | ГОСТ 27068-86 | 2.1 |
| ГОСТ 4201-79 | 2.1 | ГОСТ 9412-93 | 2.1 | ОСТ 25-11-38-84 | 2.1 |
| ГОСТ 4208- 72 | 2.1 | ГОСТ 10354-82 | 1.2 | ТУ 6-09-5169-84 | 2.1 |
| ГОСТ 4209-77 | 2.1 | ГОСТ 11293-89 | 2.1 | ТУ 6-09-5170-84 | 2.1 |
| ГОСТ 4232-74 | 2.1 | ГОСТ 11773-76 | 2.1 | ТУ 6-09-5484-90 | 2.1 |
| ГОСТ 4233-77 | 2.1 | ГОСТ 12026-76 | 2.1 |
5. Ограничение срока действия снято по протоколу № 4-93 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС4-94)
6. ИЗДАНИЕ с Изменениями № 1, 2, утвержденными в октябре 1981 г., январе 1987 г. (ИУС 1-82, 4-87)